いま世界に拡がるウイルスは、
リアルタイムで追跡できるほど進化が速い。ウイルスはいわゆる生物ではないが、
私たちヒトを含む生物と共進化する存在だ。
世界的な分子系統学者である著者が、
躍動感みなぎる“進化の舞台”へ読者を誘う。

著者プロフィール
長谷川政美(はせがわ まさみ)
1944年生まれ。進化生物学者。統計数理研究所名誉教授。総合研究大学院大学名誉教授。理学博士(東京大学)。著書に『分子系統学』(岸野洋久氏との共著)『DNAに刻まれたヒトの歴史』(共に岩波書店)、『系統樹をさかのぼって見えてくる進化の歴史』(ベレ出版)、『世界でいちばん美しい進化の教室』(監修、三才ブックス)、『共生微生物からみた新しい進化学』(海鳴社)、『進化38億年の偶然と必然』(国書刊行会)など多数。1993年に日本科学読物賞、1999年に日本遺伝学会木原賞、2005年に日本進化学会賞・木村資生記念学術賞など受賞歴多数。全編監修を務める「系統樹マンダラ」シリーズ・ポスターの制作チームが2020年度日本進化学会・教育啓発賞を受賞。

ウイルスという存在
ーヒトの進化にどうかかわってきたのかー
第30話(最終話)
構造が単純なRNAウイルス
文と写真 長谷川政美
今回は、前回の図29-6でRNAウイルスの中で最初にほかから分岐したグループ①のウイルスについて、もう少し詳しく紹介しよう。このグループのウイルスはゲノムサイズが小さくて構造が単純であり、しかもRNAウイルスの中で最初にほかから分岐したということで、RNAウイルスの中の祖先型ウイルスと見なされることが多い。しかし、これらのウイルスが本当に祖先型かどうか、本当のところは分からない。近年、さまざまな生物分類群で共通祖先が当初考えられたよりも複雑なものであり、そこから単純化するような進化が(通常「退化」と呼ばれるが)繰り返し起ったことが明らかになってきたのだ(1)。従って、RNAウイルスの共通祖先も単純なものだったとは必ずしもいえないのだ。
◎ミトコンドリアに感染するミトウイルス
第21話で巨大ウイルスを紹介した。巨大ウイルスはウイルス粒子が大きいだけでなく、ゲノムも大きかった。その対極として、ゲノムが2.1~4.4kb(kbは1000塩基)しかなく、たった一つの遺伝子しかもたないウイルスもいる。図29-6のグループ①で出てきたミトウイルス(mitovirus)と呼ばれるものである。この名前はミトコンドリアに感染することからきている。
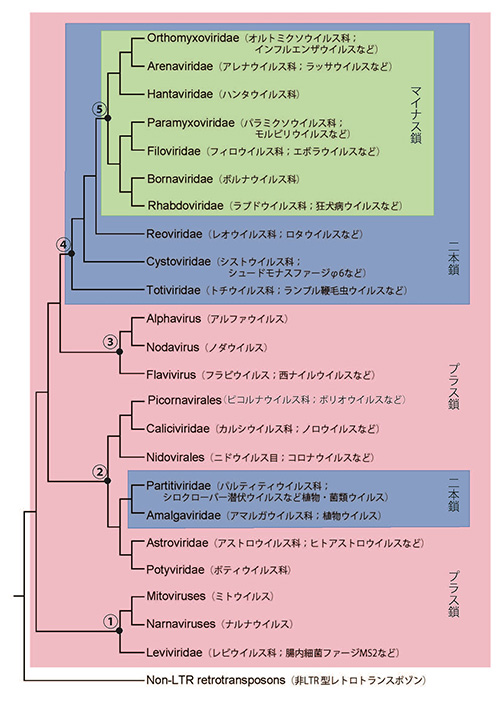
前回、RNAウイルス全体の進化を論じたが、ミトウイルスはナルナウイルス、レビウイルスとともにRNAウイルス進化の系統樹の根元近くから派生するグループ①に属する。そこで、ウイルス粒子の一般的な構造は核酸ゲノムとカプシドをもつことだと述べたが、ミトウイルスはカプシドをもたない。従ってミトウイルスはウイルス粒子になってほかの細胞に感染するわけではなく、RNA分子として宿主のミトコンドリア内にいて、宿主細胞の分裂にあわせて拡がる。第23話で紹介したレトロトランスポゾンのように宿主のゲノムに組み込まれるわけではないが、似たような仕組みで増えるのである。
ミトウイルスは1980年代に最初ニレ立枯病を引き起こす子嚢菌オフィオストマ(Ophiostoma ulmi)で見つかり、その後菌類のたくさんの系統で見つかるようになった。図30-1で示したセミに寄生するエントモフトラ(Entomophthora)という接合菌でも見つかっている(2)。ミトウイルスは宿主の菌類に対して有害な作用を及ぼすことはないが、病原菌類の毒性を弱めることはあるようだ。

ミトウイルスにはさまざまな菌類に寄生するものが知られているが、菌類のミトコンドリアは、第4話の表4-2で示した一般的な遺伝コード表(普遍コード表ともいう)とは少し違ったコード表を使っている。普遍コード表では終止コドンであるUGAがこのミトコンドリアではトリプトファン(Trp)のコドンになっているのだ。あらゆる生物の最後の共通祖先LUCAは普遍コード表を使っていたと考えられるが、その後いくつかの系統でコード表が少しだけ変異したものが進化した。
このようにほとんどの生物で普遍コード表が使われ、いくつかの系統でそれから少し変異したコード表が使われていることは、地球上のあらゆる生物が一つの共通祖先LUCAから進化したことを示している(3)。
真核生物全体の中では菌類に近い動物のミトコンドリアでも菌類と同じコード表が使われている。実は菌類のミトコンドリアに寄生するミトウイルスもまたUGAをトリプトファンのコドンとして使っている(4)。このことが、ミトウイルスがミトコンドリアの中で増殖している証拠にもなるのだ。菌類でも細胞質では普遍コード表が使われているので、ミトウイルスのゲノムを細胞質のリボソームで翻訳したならば、途中に終止コドンが入って、たんぱく質が細切れのものになってしまうはずである。
ミトウイルスは植物でも見つかっている。植物に寄生する菌類に寄生するものかと思われたが、このミトウイルスはトリプトファンをコードするのにUGAを使わない。植物のミトコンドリアは普遍コード表を採用しているので、その環境にあわせて進化したものと考えられる。なにしろこのウイルスのもつ遺伝子はRdRpのものだけだから、わずかな数の変異で環境にあわせることができるのである。
◎ミトウイルスに近縁な細菌ウイルスMS2
大腸菌に感染するウイルスにMS2ファージがある。プラス鎖RNAウイルスでレビウイルス科(Leviviridae)に分類される。ミトウイルスはレビウイルスと同じグループ①に属する。筆者は現役の研究者だった期間を通じて主に生物進化の研究に携わってきたが、ウイルスに関して専門的に研究したことはなかった。本連載で取り上げた話題のほとんどは、現役を退いたあとで文献を通じて自分で勉強したものである。しかし、本連載でウイルスの話題を書いていて、進化の研究を始めた40年以上前にウイルスの論文を出版していたことを思い出した。それがMS2ファージ(図30-2)だった(5)。以下は筆者の思い出話である。
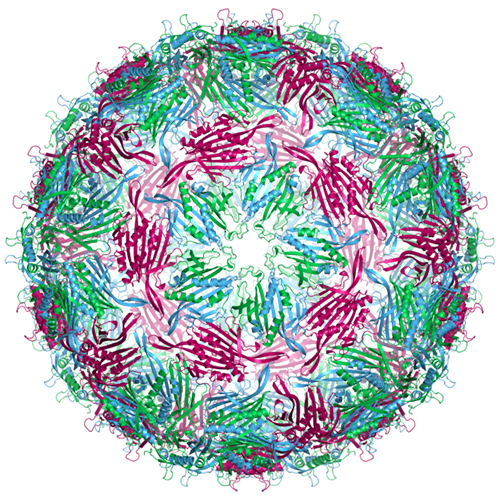
MS2のゲノムはたんぱく質をコードする4つの遺伝子だけをもつ3,569塩基の一本鎖RNAである。ちなみにSARS-CoV-2のゲノムはおよそ3万塩基、インフルエンザウイルスのゲノムはおよそ1万8千塩基の一本鎖RNAである。このようにゲノムが小さいことからMS2は1976年にゲノムが完全に解読された最初のウイルスになった。私は当時九州大学におられた宮田隆さん(現・京都大学名誉教授)と安永輝雄さん(現・大阪大学名誉教授)と共同でこの最初のウイルスゲノムデータを解析してみた。
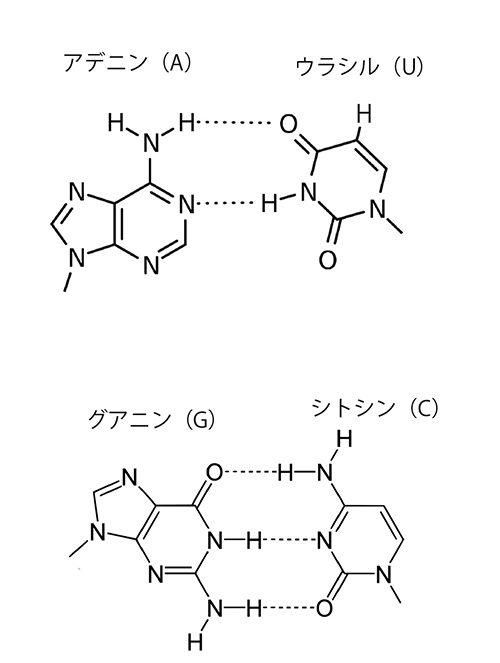
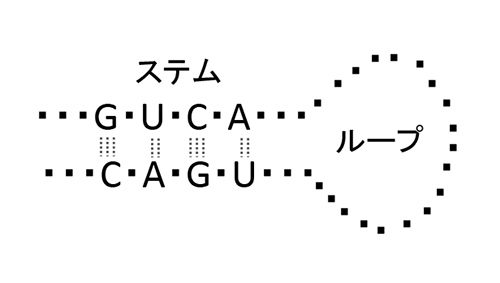
DNAは二本の鎖が相補的な塩基結合対で結ばれて安定した構造を保っている。一方、MS2ファージのゲノムはプラス鎖一本鎖RNAだから、塩基結合対が一本の鎖のなかでできてしまう。つまり一本の鎖のなかで、アデニン(A)とウラシル(U)、グアニン(G)とシトシン(C)の間で相補的な塩基結合対ができる(図30-3)。連続した塩基結合対が並んだ領域をステム、対ができない領域をループという(図30-4)。塩基の並び方を一次構造というが、ステムやループなど塩基対形成の有無を二次構造という。二次構造をもったRNA分子がさらに折りたたまれて立体的な三次構造を作るのである。
MS2のRNAゲノムの二次構造はゲノムの安定性に関わる。1976年当時、一本鎖RNA分子の一次構造から二次構造を推定する方法が開発されており、MS2ゲノムの二次構造も知られていた。われわれが着目したのは、塩基結合対が並んだステム領域とループ領域とで塩基組成に違いがあるかどうかであった。結果は、コドンの3番目の塩基は、ステム領域ではループ領域よりもGやCが多いということであった。
図30-3で分かるようにGC対は3本の水素結合、AU対は2本の水素結合で形成されるものであり、そのためにGC対はAU対よりも熱力学的に安定している。従ってコドンの3番目の塩基としてステム領域でGC対が多いということは、GあるいはA、CあるいはUを選ぶ際に(コドンの3番目はどちらの塩基を選んでもたいていは同じアミノ酸をコードする)、熱力学的に安定したゲノムにするために、GかCを選ぶ傾向があることを示していると解釈できた。遺伝情報を保持するゲノムは分子として安定したものである必要があるだろう。
SARS-CoV-2でも、二次構造上ステムを組むと推定される領域はループ領域にくらべて変異が少ないということが言われており(7)、二次構造の安定性はRNAウイルスの進化にとって重要な問題である。SARS-CoV-2ゲノム中では、63%の塩基はステム領域を構成しており、これらの塩基座位の変異率はループ領域にくらべて低く抑えられている。ゲノムRNAの二次構造が変異の仕方に対して制約を与えているのだ。コロナウイルスと同じプラス鎖一本鎖ウイルスであるC型肝炎ウイルスが、宿主の免疫系の攻撃をうまく逃れて何十年にもわたって持続感染できることが、ウイルスゲノム全体の二次構造を含む立体構造と関連しているという指摘もある(8)。
確かにMS2ファージゲノムのステム領域でGC対が多いということは、アミノ酸を変えないような同義置換でステムのGC対を増やす方向に進化が進んだと解釈することができるが、一つのウイルスを調べただけでは進化の方向性は分からない。またステム領域でGC対が多くなるのは、GC対のほうがAU対よりも安定しているため、GC対が多くなるように二次構造が作られる傾向にあるからかもしれないのだ。そうだとすると、ステム領域でGC対が多いのは、RNAゲノムを熱力学的に安定化させるためにGCを増やすような選択圧が働いたためというよりは、単にGC対が多くなるような二次構造が作られることを示しているだけかもしれない。
このように、ゲノムの特徴をいろいろ調べることは簡単だが、なぜそのような特徴が進化したかという因果関係を解明することは容易ではない。その意味で40年以上前のこの研究は、未熟なものであった。それでも思い返してみると、あの頃はウイルスに限らず、遺伝子の塩基配列データが次々に出てきてこの分野の研究に非常に活気のある時代だった。ただし、今と違って誰でも自由に使えるようなデータベースはまだ整備されておらず、論文として発表された塩基配列データを自分でコンピュータに入力しなければならなかった。
そのような状況は、最初にミトコンドリアのゲノムデータが発表された1981年になっても続いていた(6)。この論文では3ページにわたるFigureとして16,569個の塩基の配列とそれに対応するアミノ酸配列が掲載されていた。現在では研究者向けのSNS「ResearchGate」でpdfが簡単に入手できるが、その当時は紙に印刷されたものしかなかった。拡大コピーというものもなかったので、雑誌からA4判にコピーされた細かい文字を読みながら自分で入力するしかなかったのだ。しかもA、T、G、CのうちのGとCが不鮮明で見分けにくいこともある。
私の場合、実際の作業は秘書のかたにほとんどやってもらったが、GとCが見分けにくいところは一緒に細かくチェックしながら進めた。Nature誌のこの論文はこの点まだましだったが、論文によっては、GとCの区別がもっと難しいフォントを使っているものもあり、ほかのひとにデータを使わせないようわざとまぎらわしいフォントを使っているのではないかと勘繰りたくなるものさえあった。そのためG、Cという塩基の表示は変えるべきではないかと本気で考えたものであった(例えば小文字ならばはっきり区別できる)。数年後にデータベースが公開されるようになってチェックしたところ、われわれがNature誌から入力したデータには間違いがないことが分かり、秘書の有能さに感謝したものであった。
このような時代、必然的にデータを細かく見ることが習慣になっていた。ところが現在の大量ゲノムデータの時代、研究スタイルは全く様変わりしてしまった。現在では公開されたデータベースからだれでも自由にデータがダウンロードできるようになり、こうして集められたデータを解析するためのソフトウエアも豊富に整備されている。これらのツールを駆使することによって、だれでも簡単に解析結果が得られるようになってきた。
このことは、科学の進歩であろう。科学ではだれがやっても同じような結果が得られることが大事だからである。しかし、一方で弊害も生じている。データ解析から推論を行なう場合、さまざまな前提があるが、研究者の中には自分が使っている解析法を十分理解しないで、ただ機械的にデータを扱うひともいる。しかもデータがあまりにも大量であるために、個々のデータを見る機会もなく、解析の中身はブラックボックスになってしまい、おかしな結果が得られても問題点がなかなか分からないのである。
現状はこのようにいろいろな問題があるが、人間の認識能力ではブラックボックスにしか見えなくても、これからはうまく教育された人工知能を使って一段階進んだ解析が可能になっていくであろう。科学者が経験によって培ってきた直感的な判断能力を、教育された人工知能にももたせられるようになるのだ。また人工知能ならば細部にも目を光らせながら、大量データを扱うことができる。このようにこれからの科学界は、筆者が研究を始めた時代とは大きく様変わりし、筆者のような古い世代の研究者にとっては戸惑うことも多くなるであろう。いずれにしても、本連載を機に最新の研究について勉強する機会ができ、大いに刺激になった。
【引用文献】
1. O’Malley, M.A., Wideman, J.G., Ruiz-Trillo, I. (2016) Losing complexity: the role of simplification in macroevolution. Trends Ecol. Evol. 31, 608-621.
2. Nibert, M.L. et al. (2019) Mitovirus and mitochondrial coding sequences from basal fungus Entomophthora muscae. Viruses 2019, 11, 351.
3. 大澤省三(1997)『遺伝暗号の起源と進化』 渡辺公綱・上田卓也・大濱武訳、共立出版.
4. Shackelton, L.A., Holmes, E.C. (2008) The role of alternative genetic codes in viral evolution and emergence. J. Theoret. Biol. 254, 128-134.
5. Hasegawa, M., Yasunaga, T., Miyata, T. (1979) Secondary structure of MS2 phage RNA and bias in code word usage. Nucl. Acids Res. 7, 2073-2079.
6. Anderson, S. et al. (1981) Sequence and organization of the human mitochondrial genome. Nature 290, 457-465.
7. Simmonds, P. (2020) Pervasive RNA secondary structure in the genomes of SARS-CoV-2 and other coronaviruses. mBio 11(6), e01661-20.
8.Simmonds, P. et al. (2020) Impact of virus subtype and host IFNL4 genotype on large-scale RNA structure formation in the genome of hepatitis C virus. RNA 26, 1541-1556.
*もっと「進化」について知りたい人の入門書:
☆本連載が本になりました!
長谷川政美著『ウイルスとは何か:生物か無生物か、進化から捉える本当の姿』 (中公新書)。ウイルスは恐ろしい病原体か、あらゆる生命の源か――。進化生物学の最前線から、その正体に迫る。

☆いちばん新しい本!
長谷川政美著『進化生物学者、身近な生きものの起源をたどる
』 (ベレ出版)。 イヌやネコやクマなど身近な生き物はすべて進化していまここにいる。もちろんヒトも。生き物の進化が一目でわかる「系統樹マンダラ」を多数掲載(系統樹の「見方」付き)。ささやかな「現代版 種の起原」ができました。

☆はじめの一冊にオススメ!
長谷川政美監修・畠山泰英構成『世界でいちばん素敵な進化の教室
』 (三才ブックス)。 本書は美しい写真とQ&A形式の簡潔な文章で、38億年におよぶヒトを含む生き物の進化を解説した超入門ビュアルブックです。子供から大人まで気軽に楽しんでいただけます。
4刷(2022年10月)。





