いま世界に拡がるウイルスは、
リアルタイムで追跡できるほど進化が速い。ウイルスはいわゆる生物ではないが、
私たちヒトを含む生物と共進化する存在だ。
世界的な分子系統学者である著者が、
躍動感みなぎる“進化の舞台”へ読者を誘う。

著者プロフィール
長谷川政美(はせがわ まさみ)
1944年生まれ。進化生物学者。統計数理研究所名誉教授。総合研究大学院大学名誉教授。理学博士(東京大学)。著書に『分子系統学』(岸野洋久氏との共著)『DNAに刻まれたヒトの歴史』(共に岩波書店)、『系統樹をさかのぼって見えてくる進化の歴史』(ベレ出版)、『世界でいちばん美しい進化の教室』(監修、三才ブックス)、『共生微生物からみた新しい進化学』(海鳴社)、『進化38億年の偶然と必然』(国書刊行会)など多数。1993年に日本科学読物賞、1999年に日本遺伝学会木原賞、2005年に日本進化学会賞・木村資生記念学術賞など受賞歴多数。全編監修を務める「系統樹マンダラ」シリーズ・ポスターの制作チームが2020年度日本進化学会・教育啓発賞を受賞。

ウイルスという存在
ーヒトの進化にどうかかわってきたのかー
第4話
SARS-CoV-2の起源
文と写真 長谷川政美
第2話では、COVID-19を引き起こすコロナウイルスSARS-CoV-2のゲノムデータの分子系統学的な解析によって、感染経路を追跡する話をしたが、今回は同様の手法でもっと遡ってこのウイルスがどのような進化の歴史をたどって生まれたかを見ることにしよう。
◎コウモリが宿主の近縁なコロナウイルス
SARS-CoV-2は、2002年に中国広東省から広まったSARS(重症急性呼吸器症候群)を引き起こしたSARSコロナウイルス(SARS-CoV)に近縁なウイルスであるが、SARS-CoVが進化して生まれたものではない。
ヒト以外の動物に感染するコロナウイルスの中で、SARS-CoV-2とよく似たゲノム配列をもつものが2013年に中国雲南省においてキクガシラコウモリ属の野生コウモリから採取されている(図4-1)。

このナカキクガシラコウモリから得られたウイルス株(RaTG13)は、SARS-CoV-2とゲノム配列の96.2%が一致する。更に2019年には同じ雲南省のマレーキクガシラコウモリからは93.3%一致する別の株が得られている(RmYN02)。2002年にSARSを引き起こしたSARS-CoVはSARS-CoV-2とゲノム配列は似ているものの、79.0%しか一致しないので、SARS-CoV-2はSARS-CoVから直接進化したものではなく、キクガシラコウモリ属を自然宿主とする別のコロナウイルスの系統から独立に進化したと考えられる。
ところが話は簡単ではない。ゲノム全体でくらべてマレーキクガシラコウモリのRmYN02よりもナカキクガシラコウモリのRaTG13のほうがSARS-CoV-2との相同性(塩基の一致率)が少し高いが、スパイクたんぱく質遺伝子だけでくらべると、SARS-CoV-2に対するRmYN02とRaTG13の相同性は、それぞれ71.9%と92.9%と大きく違っている。この極端な違いは、RmYN02が進化の過程でもっと遠い関係にあるコロナウイルスとの間で組換えを起して、スパイクたんぱく質遺伝子(あるいはその一部)を取り込んだ結果と考えられるのだ。
このように組換えを起したと考えられる領域を除いて、残りのゲノム領域だけで系統樹を描くと、図4-2の左のようになる。
◎センザンコウ由来のコロナウイルス
野生で中国に分布するセンザンコウはミミセンザンコウ(図4-3)という種であり、マレーセンザンコウは分布しないので、この2種類のコロナウイルスは外国から違法に持ち込まれた動物に感染していたものである。

図4-2の左の図で示したように、センザンコウのGD410721とGX_P1Eは、ゲノム全体からスパイクたんぱく質遺伝子を除いた配列で描いた系統樹では、SARS-CoV-2に対してはマレーキクガシラコウモリやナカキクガシラコウモリのコロナウイルスよりも遠い関係になっている。ところがスパイクたんぱく質の受容体結合領域(51アミノ酸)の配列だけで系統樹を描くとSARS-CoV-2に一番近縁なのがマレーセンザンコウのGD410721になる(図4-4)。

◎いったいどこから?
これまでに知られているウイルスの中でSARS-CoV-2に一番近縁なのは、スパイクたんぱく質遺伝子以外のゲノム領域ではマレーキクガシラコウモリのRmYN02であるが、RmYN02のスパイクたんぱく質の受容体結合領域はSARS-CoV-2のものとは系統的に非常に離れている(図4-4)。
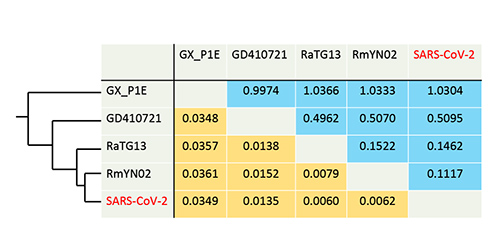
一方、スパイクたんぱく質の受容体結合領域に関しては、SARS-CoV-2に一番近縁なのはマレーセンザンコウのGD410721になる。特に受容体との結合に際して重要と考えられる6カ所のアミノ酸座位がこの2つのウイルスで完全に一致するのに対して、マレーキクガシラコウモリのウイルスでは6つのアミノ酸のうちの5カ所が違っている(表4-1)。

従って、マレーキクガシラコウモリのRmYN02に近縁なSARS-CoV-2の祖先が、センザンコウのGD410721に近縁な祖先ウイルスからスパイクたんぱく質の受容体結合領域の遺伝子を組換えで取り込んだ可能性が考えられるのである。
COVID-19は、武漢の海鮮市場の関係者の間で最初に拡がったと報道されていた。海鮮市場といっても魚介類だけでなく、哺乳類、鳥類、爬虫類など多くの野生動物が生きたまま売られていたので、そこで売られていた可能性のあるセンザンコウを介してヒトに感染したのではないか、と疑われたのである。しかし、いろいろ調べてみると以下で述べるようにその可能性は低そうである。
ゲノム全体ではSARS-CoV-2に近縁なナカキクガシラコウモリのRaTG13は、すでに2013年に採取されていたウイルスであった。当時、武漢ウイルス学研究所のZheng-Li Shi(石正麗)らのグループは、SARSを引き起こしたSARS-CoVの起源を探るべく、中国各地の野生コウモリからコロナウイルスを採取していた。RaTG13はそのプロジェクトで採取されたものである。
2013年に雲南省のTong-Guanという町でRhinolophus affinis(ナカキクガシラコウモリ)から採取されたウイルスということで、のちに「RaTG13」と呼ばれるようになった。このウイルスのゲノム配列はSARS-CoVのものとはだいぶ異なるためにあまり注目されなかったが、2020年1月になってSARS-CoV-2の配列が明らかになると、これと近縁であることが分かり、注目されるようになったのである。
話が込み入ってくるが、SARS-CoV-2のスパイクたんぱく質の受容体結合領域だけがセンザンコウのGD410721に近縁なことから、組換えでこの部分だけをGD410721から取り込んでSARS-CoV-2が生まれたという考えに対して異論がある(2)。スパイクたんぱく質遺伝子のほかの領域の相同性を見ると、SARS-CoV-2とGD410721の間の相同性が受容体結合領域だけで特別高いわけではないのに対して、SARS-CoV-2のRaTG13との相同性は受容体結合領域以外ではGD410721との相同性よりも高いのである。従って、RaTG13が、もともとSARS-CoV-2に近い受容体結合領域をもっていたが、SARS-CoV-2から進化的に分かれた後で、その部分だけを遠い関係にあるウイルスから組換えによって取り込んだと考えられるのである。そうだとすると、表4-1で示したSARS-CoV-2特有の6カ所のアミノ酸座位は、ナカキクガシラコウモリのRaTG13とセンザンコウのGD410721の共通祖先がすでにもっていたものであり、その後RaTG13は組換えで違ったものに変わってしまったことになる。
文献(2)ではスパイクたんぱく質を除くとナカキクガシラコウモリのRaTG13よりもさらにSARS-CoV-2と近縁なマレーキクガシラコウモリのRmYN02が解析に含められていないが、上の議論でRaTG13をRmYN02に読み替えればほぼ同様の議論が成り立つ。RmYN02もSARS-CoV-2に近い受容体結合領域をもっていたが、組換えで違ったものに変わってしまったと思われる。この議論の基本は、SARS-CoV-2とGD410721の間の相同性が受容体結合領域だけで特別高いわけではないということであり、RaTG13とRmYN02でこの領域だけがSARS-CoV-2と特別違った配列をもっていることから、組換えで獲得されたものであろうということである。
現段階ではこのシナリオは一番説得力があるように思われる。センザンコウがSARS-CoV-2の出現に関わったのではなく、マレーキクガシラコウモリのもっていたウイルスがヒトに感染するように進化したのである。マレーキクガシラコウモリのウイルスのほうは、その後、受容体結合領域の部分が組換えによって別のものに変わってしまったのだ。このようにコロナウイルスの受容体結合領域付近では頻繁に組換えが起こっているようである。
◎空白の数十年間
SARS-CoV-2が組換えを起して変わってしまう前のマレーキクガシラコウモリやナカキクガシラコウモリのウイルスから進化したものだとしても、SARS-CoV-2のゲノムはこれらコウモリのウイルスのものと完全に一致するわけではない。これだけの違いを生み出すためには、数十年分の変異の蓄積が必要である。
スパイクたんぱく質遺伝子を除いたゲノム配列でRmYN02とRaTG13がSARS-CoV-2から分かれた年代を推定すると、それぞれ37年前(95%信頼区間:18-56年前)と52年前(28-75年前)となる(1)。パンデミックが起る前のこの数十年間の状況が依然として闇に包まれているのである。どうも、ここで扱っているSARS-CoV-2に近縁な4種類のウイルスだけでは、ヒトへのパンデミックを引き起こしたこのウイルスの起源の問題に肉薄するには不十分なようである。野生動物に感染しているコロナウイルスをもっと徹底的に調べ上げなければ、SARS-CoV-2の直接の祖先に迫ることは出来ないであろう。
SARS-CoV-2の祖先がキクガシラコウモリを宿主とするウイルスだったことは確かだと思われるが、SARS-CoV-2とそっくりなウイルスは野生動物からはまだ見つかっていないのだ。コウモリからヒトに感染するようになるだけでは世界的な大流行であるパンデミック(pandemic)には至らない。それだけでは世界の限られた地域で時おり見られる風土病に過ぎない。ある地域だけで流行する感染症をエンデミック(endemic)という。このウイルスがヒトからヒトへ感染する能力を獲得してはじめてパンデミックになるのである。このようなウイルス進化の途中の過程がどこで、いつ起こったかについては、まったく不明なのである。
◎コロナウイルス進化の分子時計
表4-2に遺伝コード表を示した。伝令RNAの塩基配列がたんぱく質のアミノ酸配列の翻訳される際の規則で、3つの連なった塩基(三連塩基、あるいはコドンという)が1つのアミノ酸をコードする。
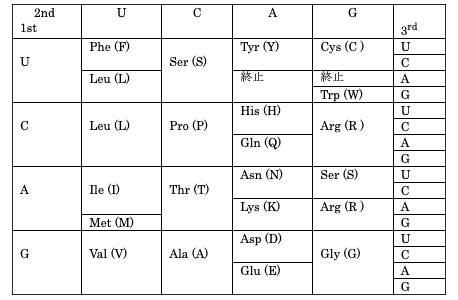
例えばUUUというコドンはフェニールアラニン(Phe)をコードするが、コドンの3番目のUがCに置き換わってもPheのままである。このようなU→C変異を同義置換という。ところが同じUがAに置き換わるとロイシン(Leu)という別のアミノ酸に変わってしまう。このようなU→A変異は非同義置換という。
共通祖先から進化した二種間でたんぱく質をコードしている遺伝子 DNA の塩基配列の違い(距離)は、二通りのやり方で測られる。アミノ酸の違いを生み出さないような塩基の違いで測った同義距離(dS; 同義という意味の Synonymous )とアミノ酸の違いを生み出すような塩基の違いで測った非同義距離(dN; 非同義という意味の Non-synonymous で、アミノ酸距離ともいう)である。コドンの三番目の塩基が変わってもアミノ酸は変わらないことが多いが、アミノ酸を変えないような塩基置換を同義置換という。同義置換が起っても、たんぱく質としては変わりがないので、そのような塩基置換はほぼ中立的だと考えられる。
図4-2の右に、SARS-CoV-2および動物を宿主とする近縁なコロナウイルスゲノム(スパイクたんぱく質を除く)間の塩基の違いで測った同義距離と非同義距離を示した。

分子進化速度が時間的に一定であることを「分子時計」という。分子時計を用いて系統樹上での分岐がいつ頃起ったかを推定することができる。実際にはさまざまな理由で進化速度は変動するが、共通祖先からキクガシラコウモリのRmYN02とヒトのSARS-CoV-2へ至る系統で同義置換速度に違いがないということは、注目に値する。
塩基置換はウイルスのゲノムが宿主細胞内で複製される際の複製ミスとして起るが、その起りかたに違いがないということは、2つの系統で同じように複製が繰り返されてきたことを意味する。コウモリとヒトという異なる環境では、ウイルスの突然変異率に違いが見られてもおかしくないが、それがないのである。
一方、アミノ酸置換を伴う非同義距離は同義距離よりも一桁以上値が小さくなっている。ゲノムの複製ミスは同義置換も非同義置換も同じように起っていると考えられるが、アミノ酸を変えるような変異は、ウイルスにとって有害なことが多いので、自然選択によって取り除かれるために(これを負の自然選択という)、非同義距離は同義距離よりも小さくなっているのである。従って、膨大な数の変異が取り除かれていることになる。そのため、負の自然選択を純化選択ともいう。
【引用文献】
1. Wang, H., Pipes, L., Nielsen, R. (2020) Synonymous mutations and the molecular evolution of SARS-Cov-2 origins. bioRxiv doi: https://doi.org/10.1101/2020.04.20.052019.
2. Boni, M.J. et al. (2020) Evolutionary origins of the SARS-CoV-2 sarbecovirus lineage responsible for the COVID-19 pandemic. Nature Microbiol. https://doi.org/10.1038/s41564-020-0771-4
*もっと「進化」について知りたい人の入門書:
☆本連載が本になりました!
長谷川政美著『ウイルスとは何か:生物か無生物か、進化から捉える本当の姿』 (中公新書)。ウイルスは恐ろしい病原体か、あらゆる生命の源か――。進化生物学の最前線から、その正体に迫る。

☆いちばん新しい本!
長谷川政美著『進化生物学者、身近な生きものの起源をたどる
』 (ベレ出版)。 イヌやネコやクマなど身近な生き物はすべて進化していまここにいる。もちろんヒトも。生き物の進化が一目でわかる「系統樹マンダラ」を多数掲載(系統樹の「見方」付き)。ささやかな「現代版 種の起原」ができました。

☆はじめの一冊にオススメ!
長谷川政美監修・畠山泰英構成『世界でいちばん素敵な進化の教室
』 (三才ブックス)。 本書は美しい写真とQ&A形式の簡潔な文章で、38億年におよぶヒトを含む生き物の進化を解説した超入門ビュアルブックです。子供から大人まで気軽に楽しんでいただけます。
4刷(2022年10月)。





