いま世界に拡がるウイルスは、
リアルタイムで追跡できるほど進化が速い。ウイルスはいわゆる生物ではないが、
私たちヒトを含む生物と共進化する存在だ。
世界的な分子系統学者である著者が、
躍動感みなぎる“進化の舞台”へ読者を誘う。

著者プロフィール
長谷川政美(はせがわ まさみ)
1944年生まれ。進化生物学者。統計数理研究所名誉教授。総合研究大学院大学名誉教授。理学博士(東京大学)。著書に『分子系統学』(岸野洋久氏との共著)『DNAに刻まれたヒトの歴史』(共に岩波書店)、『系統樹をさかのぼって見えてくる進化の歴史』(ベレ出版)、『世界でいちばん美しい進化の教室』(監修、三才ブックス)、『共生微生物からみた新しい進化学』(海鳴社)、『進化38億年の偶然と必然』(国書刊行会)など多数。1993年に日本科学読物賞、1999年に日本遺伝学会木原賞、2005年に日本進化学会賞・木村資生記念学術賞など受賞歴多数。全編監修を務める「系統樹マンダラ」シリーズ・ポスターの制作チームが2020年度日本進化学会・教育啓発賞を受賞。

ウイルスという存在
ーヒトの進化にどうかかわってきたのかー
第2話
新型コロナウイルス感染症を追う
文と写真 長谷川政美
◎1月上旬にゲノム配列公開
のちに「COVID-19」と呼ばれるようになるコロナウイルスによる感染症は、2019年12月に中国武漢で発生した。朝日新聞では2020年の1月10日に、「中国武漢で海鮮市場の関係者を中心に新型コロナウイルスによる肺炎患者が15人確認された」と小さく報道されたのが始まりであった。その後、この感染症は世界中に拡がり、2020年9月末現在までに、世界で確認された患者数が3360万人に達し、100万人以上の命を奪った。
実際にはこの数字よりもはるかに多くの人がこの感染症が直接的あるいは間接的原因で亡くなっていることは確かである。死亡者数のピークにあわせて公式にはこの感染症の患者とは見なされない死亡者の数も増加しており、南アフリカやペルーなどの国では、その数が公式の感染死亡者数をはるかに超えているのである(1)。この感染症を機にわれわれの生活も大きく変わった。
WHOによってこの感染症は、「COVID-19(2019年コロナウイルス感染症)」と命名され、この感染症を引き起こすウイルスの実体も分かってきた。実際には武漢ウイルス学研究所では、この感染症が日本で報道される前の1月7日までにはこのウイルスのゲノム配列を決定しており、1月11日にはデータを公開した。前日の1月10日には、上海の復旦大学のグループが別の患者のウイルスのゲノム配列を公開していた。日本で報道されるようになった頃には、このウイルスについての研究はそこまで進んでいたのである。
これが2002年に中国広東省から拡まったSARS(重症急性呼吸器症候群)の原因となったSARSコロナウイルス(SARS-CoV)に近縁なものであることから、ウイルス分類国際委員会のコロナウイルス部会によって、「SARSコロナウイルス2型(SARS-CoV-2)」と命名された(2)。ところが、SARSは病気の名前であり、COVID-19はSARSとは違った病気であることから、ウイルスの名前としてはそれとは区別して「HCoV-19(2019年ヒトコロナウイルス)」と呼ぶべきだという意見もある(3)。
◎突然変異しやすい理由
SARS-CoV-2(あるいはHCoV-19)は、コロナウイルス科のウイルスである(図2-1)。普通の生物のゲノムは二本鎖DNAであるが、コロナウイルスのゲノムは一本鎖RNAである。
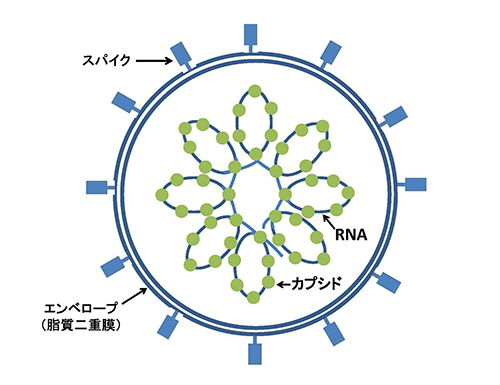
一本鎖RNAは二本鎖DNAにくらべると不安定で変異を起こしやすい。インフルエンザウイルスのゲノムも一本鎖RNAであり、しかもインフルエンザウイルスを含めたたいていのRNAウイルスがゲノムを複製する際には、エラーが生じてもそれを修復する機構がないので、突然変異率が非常に高いのだ。そのため、一人の患者のウイルス集団のなかでさえ、違ったゲノム配列が混ざっていることが多く、そのようなウイルスの集団を「擬種(quasi-species)」と呼ぶことがある。
たくさんの宿主に感染すれば、それだけ新しい変異が生じる可能性が高まるので、以前に罹ったインフルエンザの免疫が新しいインフルエンザでは効かないといったことが起こる。そのため、インフルエンザウイルスでは毎年のように新しいワクチン開発が必要になるのである。
一方コロナウイルスは一本鎖RNAの中では珍しく複製の際に起こるエラーを修復する機構をもっているため、コロナウイルスの1塩基座位あたりの変異率はインフルエンザウイルスにくらべると低い。
インフルエンザウイルスは1回複製するたびにゲノムあたり2.4~3.4個の突然変異を蓄積する。コロナウイルスはこれにくらべると塩基当たりでははるかに変わりにくいが、コロナウイルスは一本鎖RNAウイルスの中では最大のおよそ30kb(kb: 1000塩基)ものゲノムサイズをもっているために、ゲノム全体で蓄積していく変異数でみるとそれぞれの系統で年あたり平均18~54個の突然変異を蓄積する(4)。従ってこの変異を使ってこのウイルスの感染経路を追うことができる。
◎ゲノムデータで感染経路を追う
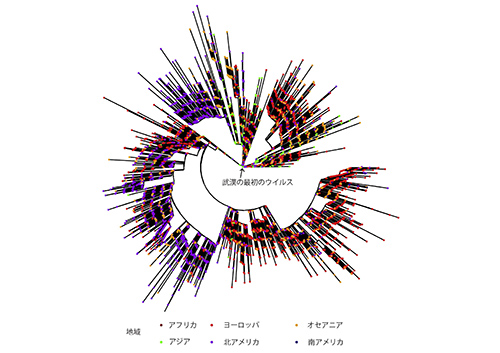
2019年12月に武漢で採取されたSARS-CoV-2の最初のゲノム配列は2020年1月上旬には公開され、その後感染が世界中に拡まるにつれてデータ量も爆発的に増え、2020年10月7日現在で13万9000件に達している(https://www.gisaid.org/)。これらのゲノムデータを用いて、このウイルスの感染経路を含めて様々なことが明らかになってきた。
まず世界中に広まったSARS-CoV-2はすべて2019年末の武漢で採取されたウイルスに非常に近い1つの祖先ウイルスから由来していることが分かる(図2-2)(4)。
オランダでは2020年2月27日にCOVID-19の最初の感染者が確認された。その後間もない3月にオランダ南部の3つの病院の医療従事者1万2022人の15%にあたる1796人を調べたところ、5%にあたる96人がSARS-CoV-2陽性となったという。このことから院内感染が疑われた。しかし、陽性の医療従事者50人と入院患者18人のウイルスのゲノムを調べて系統樹を描いたところ、ほとんどの感染は院内感染ではなく、病院外から独立に持ち込まれたものであることが判明した(5)。同じ時期に一つの病院で複数の感染者が出たとしても、必ずしも院内感染によるものだとは限らないことが、ゲノムの解析で明らかにされたのである。
また、アメリカ・カリフォルニア州北部の感染者から得られたSARS-CoV-2のゲノムデータをアメリカ各地や世界中から得られたものとあわせて系統樹解析を行なったところ、少なくとも7つのいろいろな地域から独立に持ち込まれたものであることが判明した(6)。SARS-CoV-2は感染するたびに変異するほど突然変異率は高くないので、まったく同じゲノムのウイルスをもった感染者が何人かいるが、感染を繰り返す間に少しずつ変異を蓄積するので、感染経路を追うことができるのである。
イギリスの研究者たちはさらに大規模な解析を行なった(7)。彼らはイギリスの感染者から集めた2万件以上のSARS-CoV-2のゲノムデータを世界中のデータとあわせて系統樹解析を行ない、イギリスで感染しているウイルスには、1356個の系統があることを明らかにした。つまり、外国から1356回にわたって独立に持ち込まれたということである。その内訳は、スペイン、フランス、イタリアからが最も多く、それぞれ34%、29%、14%になった。
ただし、このように膨大な数の配列データの系統樹解析では、細部まで信頼性の高い系統樹が得られているとは限らない。ある程度の数の置換が蓄積していないと、枝分かれの順番をはっきりと確定することは難しいので、このような解析をもとにして議論する際には注意が必要である(8)。
◎新しい変異によって感染力が高まったか
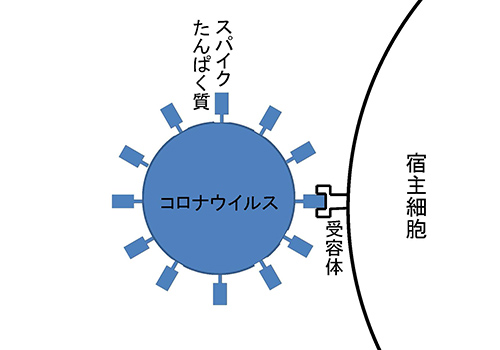
コロナウイルスのスパイクたんぱく質は、コロナウイルスの名前の由来になったウイルス表面の突起を形づくるものである。SARS-CoV-2が宿主の細胞に入り込むときは、ウイルスの表面にあるスパイクたんぱく質が、宿主細胞の受容体である、ACE2(アンジオテンシン変換酵素2)と最初にくっつくことが必要である(図2-3)。スパイクたんぱく質の受容体結合領域は、ヒトのACE2に結合しやすいようになっているのである。
2020年3月1日以前では、この変異ウイルスはヨーロッパ以外では極めて稀なものであったが、5月になると世界中で採取されたウイルスの大半はこの新しい型だった。この型が世界中で増えていることは確かであるが、武漢で最初に広まった型にくらべて感染力が高まったためなのか、あるいはヨーロッパで最初に広まったウイルスがたまたまこの型だったためなのかは分からない。進化では特別な理由がなくても、たまたま祖先になったものがその後の進化の動向を決めることがよくある。これを「創始者効果」という。世界で一番感染者数の多いアメリカには、中国から直接持ち込まれたものよりも、ヨーロッパ経由のものが多いのである。
この論文(引用文献〔9〕)では、SARS-CoV-2のスパイクたんぱく質遺伝子の2つの型、D614とG614を別のウイルスに組み込んで発現させて、ヒトの培養細胞に対して感染力に差があるかどうか調べたところ、G614のほうがD614よりも感染力が高かったという。しかし、SARS-CoV-2でこの変異が本当に感染力を高めているかどうかについては、疑問視する専門家も多いが(10)、ウイルスが次第に変化しているのは確かである。
ウイルスに変異があれば、当然感染力や病気の重篤さに差が生じる可能性はある。シンガポールで「ORF8」という遺伝子の一部が欠失した変異ウイルス(382塩基が欠失しているので「Δ(デルタ)382変異体」という)が見つかった。同じ変異体が2020年の2月に武漢から台湾に戻った人からも検出されている。
2020年の1月から3月にかけてCOVID19に感染した29人はこの変異体をもっていたが、この中で酸素吸入を必要とするほど重症化した人は1人もいなかった。一方、この変異のないウイルスに感染した92人のうち26人は酸素吸入を必要としたという。このような違いは年齢や持病の有無などによって生じている可能性はあるが、そのような効果を考慮しても、変異ウイルスの病原性の違いは有意に認められたという(11)。
ところでこれ以降、Δ382変異体は見つかっていない。このような変異をもったウイルスが増えればCOVID19はヒトにとって軽い病気になるが、実際にはウイルスが生き残る上では不利な変異だったので、消えてしまったのかもしれない。
さまざまな変異体ウイルスは常に出現しており、その中で自然選択が働いてウイルスが増殖する上で有利な特徴をもった次の時代の主流が生まれ、ウイルスの進化が続いていく。
◎祖先ウイルスのゲノム配列
2020年10月7日現在で13万9000件のSARS-CoV-2ゲノム配列がデータベースに登録されているという話をしたが、これには2019年12月の武漢での最初のウイルスをはじめとしたさまざまな時点のウイルスが含まれる。このことは、発生以来およそ10か月間のウイルス進化の歴史を追跡できるということである。
通常の生物進化では、進化の途中の過程を詳しく追うことは難しい。化石はその過程を示してくれる貴重な手掛かりを与えるが、得られた化石が現存生物の直接の祖先であるという保証はない。現存生物の祖先に近縁な生物であったとしても、子孫を残すことなく絶滅してしまった系統かもしれないのである。
一方、SARS-CoV-2の場合は、13万9000件以上にもおよぶゲノム配列を解析することによって、次第に変化していく詳細を追うことができる。ヒトに感染するようになって以降は、祖先ウイルスのゲノム配列も完全に分かっている。ほとんどリアルタイムで、変異を蓄積しながらこのウイルスが進化していく様子さえも追うことが出来るのである。ただし、第4話のテーマである、この系統樹をさかのぼってそもそもSARS-CoV-2が何に由来するウイルスかという問題に関しては、祖先配列が必ずしも残っているわけではなく、不明なことも多い。
1. Viglione, G. (2020) The true toll of the pandemic. Nature 585, 22-24.
2. Coronaviridae Study Group of the International Committee on Taxonomy of Viruses (2020) The species Severe acute respiratory syndrome-related coronavirus: classifying 2019-nCoV and naming it SARS-CoV-2. Nature Microbiol. 5(4), 536-544.
3. Jiang, S. et al. (2020) A distinct name is needed for the new coronavirus. Lancet 395, 949.
4. van Dorp, L. et al. (2020) Emergence of genomic diversity and recurrent mutations in SARS-CoV-2. Infec. Genet. Evol. 83, 104351.
5. Sikkema, R.S. et al. (2020) COVID-19 in health-care workers in three hospitals in the south of the Netherlands: a cross-sectional study. Lancet Infect. Dis. https://doi.org/10.1016/S1473-3099(20)30527-2.
6. Deng, X. et al. (2020) Genomic surveillance reveals multiple introductions of SARS-CoV-2 into Northern California. Science 10.1126/science.abb9263.
7. Pybus, O. et al. (2020) Preliminary analysis of SARS-CoV-2 importation & establishment of UK transmission lineages. Virological https://go.nature.com/37ieyvw.
8. Morel, B. et al. (2020) Phylogenetic analysis of SARS-CoV-2 data is difficult. bioRxiv https://doi.org/10.1101/2020.08.05.239046.
9. Korber, B. et al. (2020) Tracking changes in SARS-CoV-2 Spike: evidence that D614G increases infectivity of the COVID-19 virus, Cell doi: https://doi.org/10.1016/j.cell.2020.06.043.
10. Isabel, S. et al. (2020) Evolutionary and structural analyses of SARS‑CoV‑2 D614G spike protein mutation now documented worldwide. Sci. Rep. 10, 14031.
11. Young, B.E. et al. (2020) Effects of a major deletion in the SARS-CoV-2 genome on the severity of infection and the inflammatory response: an observational cohort study. Lancet 396, 603-611.
*もっと「進化」について知りたい人の入門書:
☆本連載が本になりました!
長谷川政美著『ウイルスとは何か:生物か無生物か、進化から捉える本当の姿』 (中公新書)。ウイルスは恐ろしい病原体か、あらゆる生命の源か――。進化生物学の最前線から、その正体に迫る。

☆いちばん新しい本!
長谷川政美著『進化生物学者、身近な生きものの起源をたどる
』 (ベレ出版)。 イヌやネコやクマなど身近な生き物はすべて進化していまここにいる。もちろんヒトも。生き物の進化が一目でわかる「系統樹マンダラ」を多数掲載(系統樹の「見方」付き)。ささやかな「現代版 種の起原」ができました。

☆はじめの一冊にオススメ!
長谷川政美監修・畠山泰英構成『世界でいちばん素敵な進化の教室
』 (三才ブックス)。 本書は美しい写真とQ&A形式の簡潔な文章で、38億年におよぶヒトを含む生き物の進化を解説した超入門ビュアルブックです。子供から大人まで気軽に楽しんでいただけます。
4刷(2022年10月)。