いま世界に拡がるウイルスは、
リアルタイムで追跡できるほど進化が速い。ウイルスはいわゆる生物ではないが、
私たちヒトを含む生物と共進化する存在だ。
世界的な分子系統学者である著者が、
躍動感みなぎる“進化の舞台”へ読者を誘う。

著者プロフィール
長谷川政美(はせがわ まさみ)
1944年生まれ。進化生物学者。統計数理研究所名誉教授。総合研究大学院大学名誉教授。理学博士(東京大学)。著書に『分子系統学』(岸野洋久氏との共著)『DNAに刻まれたヒトの歴史』(共に岩波書店)、『系統樹をさかのぼって見えてくる進化の歴史』(ベレ出版)、『世界でいちばん美しい進化の教室』(監修、三才ブックス)、『共生微生物からみた新しい進化学』(海鳴社)、『進化38億年の偶然と必然』(国書刊行会)など多数。1993年に日本科学読物賞、1999年に日本遺伝学会木原賞、2005年に日本進化学会賞・木村資生記念学術賞など受賞歴多数。全編監修を務める「系統樹マンダラ」シリーズ・ポスターの制作チームが2020年度日本進化学会・教育啓発賞を受賞。

ウイルスという存在
ーヒトの進化にどうかかわってきたのかー
第12話
種の壁を超えた
モルビリウイルスの感染
文と写真 長谷川政美
前回は牛疫ウイルスや麻疹ウイルスなどを中心としたモルビリウイルスを紹介した。そこで、麻疹ウイルスは巨大な都市が出現するまでは、ヒトの集団には定着できなかったであろうという話をした。その麻疹ウイルスは牛疫ウイルスと同じ祖先から進化して生まれたと考えられるが、牛疫ウイルスは家畜のウシに感染するようになる前は、野生のウシの集団内で存続していたものと考えられる。ウシの仲間には図12-1のアフリカスイギュウのように大きな集団で生活しているものが多いので、牛疫ウイルスが宿主とするには恰好の動物である。
アザラシやアシカ(図12-2)などの鰭脚類、それにイルカやクジラ(図12-3)など海生の哺乳類にも大きな集団を作るものが多く、アザラシやアシカに感染する「アザラシジステンパーウイルス」や「クジラジステンパーウイルス」などのモルビリウイルスにとっての恰好の宿主になっている。
今回はその中で「アザラシジステンパーウイルス」について詳しく紹介するとともに、ウイルスが宿主の種の壁を超えて感染することについて考えてみよう。


◎アザラシジステンパー病
1987年~1988年にかけて、ロシア・シベリアのバイカル湖で固有のバイカルアザラシ(図12-4)8万~10万匹のうちの数千匹がイヌジステンパーウイルス感染により死亡した。

続いて1988年には、ヨーロッパ大西洋の北海、バルト海、アイリッシュ海(アイルランドとグレートブリテン島の間の海)などでこれと似た感染症により大量のアザラシやアシカが死亡した。最大の犠牲はおよそ2万3千匹のゼニガタアザラシ(図12-5)の死亡だった(1)。これはバイカルアザラシに感染したウイルスとは別のアザラシジステンパーウイルスによるものだった。北海ではゼニガタアザラシの60%が犠牲になったという。

実は、ゼニガタアザラシと同じ場所にはハイイロアザラシ(図12-6)という別種のアザラシも生息している。

北海でのアザラシジステンパー病の流行は、1988年に続いて2002年にも起こったが、その時の流行ピークの2か月後にハイイロアザラシの集団を調べたところ、調べた109匹の母親のうちの13匹と84匹の幼獣のうちの6匹がアザラシジステンパーウイルスに感染していたという。ところが感染していた個体はいずれも無症状で、繁殖も順調であった(2)。
1988年の流行の際にはハイイロアザラシの死亡もあったようであるが、無症状で感染を広めるということは、ウイルスが拡散しやすい条件になる。ゼニガタアザラシでの流行に同じ地域に生息するハイイロアザラシが寄与したのかもしれない。
◎ウイルスはどこからきたか
ヨーロッパのアザラシにおける流行のもとになったウイルスはどこからきたのであろうか。1988年の流行以前に採取されていた同じ地域のアザラシの血清からは感染した証拠を示す抗体は得られなかったが、もっと北のノルウェー、グリーンランド、カナダなどに主に生息するタテゴトアザラシ(図12-7)の血清を調べたところ、感染の証拠が得られた(3)。

また1987年に北極海ヨーロッパ側のバレンツ海のタテゴトアザラシから採取されていた血清にも抗体が見出された(4)。タテゴトアザラシがアザラシジステンパーウイルスの自然宿主だと考えられる。1988年の北海などヨーロッパ大西洋での流行は、普段はもっと北の海域に生息するタテゴトアザラシの回遊によってもたらされた可能性が高いのだ。
その頃、北極海の一部のバレンツ海でタテゴトアザラシが捕食していたカラフトシシャモの個体数が激減したためにタテゴトアザラシの南の海域への大移動が起こったようである。
1987年から1988年にかけてノルウェー沿岸で漁網にかかって犠牲になったタテゴトアザラシが7万7千匹にも達したという(1)。これはアザラシジステンパーウイルスの犠牲になったゼニガタアザラシの数を超えるものである。タテゴトアザラシのこの大移動によって南に生息するゼニガタアザラシやハイイロアザラシに感染が拡がったものと考えられる。
そのときのヨーロッパにおける流行では犠牲になった動物の多くはゼニガタアザラシだったが、北極海や太平洋に感染が及ぶことはなかった。ところが2002年にアラスカの太平洋岸でラッコ(図12-8)が大量に死亡した。
死んだラッコを調べてみると、14年前に北海で見られたアザラシジステンパーウイルスと同じウイルスが検出されたのである(5)。

カリフォルニア大学デイビス校のトレイシー・ゴールドスタインらのグループによると、地球温暖化によって1988年から2002年の間に北極海の氷が解けた結果、アザラシジステンパーウイルスに感染した動物が北極海を移動できるようになり、北太平洋にまでウイルスが持ち込まれたのではないかという(6)。特に2002年の8月には北極海のヨーロッパからシベリア沿いに太平洋に抜けるルートで氷がなくなり、海生哺乳類が自由に行き来できるようになったという。気候変動が動物界におけるウイルス感染症の動向に影響を与えている可能性があるのだ。
2002年には北大西洋とつながる北海で再びゼニガタアザラシ2万2千匹以上が1988年と同じ感染症で死亡している。日本ではゼニガタアザラシが大量死した例は報告されていないが、北海道のゼニガタアザラシ集団にアザラシジステンパーウイルスに対する抗体をもっている個体がいることが報告されている(7)。
2004年と2005年には、それぞれ調べた79と77個体のうち1個体だけが抗体を保有していたが、1998年に採取されたサンプルを調べたところ9個体のうちの5個体が抗体をもっていたという。こうなると、2002年頃に北極海を経由して大西洋から太平洋にアザラシジステンパーウイルスが持ち込まれたとされる以前から、太平洋にこのウイルスがいたことになる。しかし抗体の有無だけでなく、ウイルス本体の遺伝的解析を行なわないと、その由来は追えない。
もう一つ不思議なことは、北海道のゼニガタアザラシは大量死したヨーロッパの北海のものとは別亜種であるが、同種なのに、感染による大量死が報告されていないことである。北海道とヨーロッパのゼニガタアザラシが遺伝的に違っている可能性はあるが、感染症による大量死には環境要因も関わっていて、北海における環境汚染が免疫を抑制して大量死を招いたという説もある(7)。
実はイヌジステンパーウイルスとアザラシジステンパーウイルスは南極にまで到達しているのだ(8)。1955年には南極大陸西部の南極半島近くのカニクイアザラシが大量に死亡した。イヌジステンパーウイルスによる症状に似ていたが、血清学的な証拠は得られていない。その後、南極半島近くのヒョウアザラシやカニクイアザラシがイヌジステンパーウイルスの抗体をもっていることが確かめられた。
南極には陸上の食肉類はいないので観測隊の犬ぞり用に持ち込まれたイヌからの感染が疑われたが、南極のアザラシの中には南アメリカ、ニュージーランド、オーストラリア、南アフリカなどにも回遊するものがあるので、ウイルスの由来は分からない。さらに南極大陸東部のウェッデルアザラシがアザラシジステンパーウイルスの抗体をもっていた。このウイルスの由来はさらに謎に満ちている。
◎種の壁を超えた感染
ウイルスが細胞に感染する際の最初のステップが細胞表面にある受容体との結合である。SARS-CoV-2の場合は、アンジオテンシン変換酵素2(ACE2; 図2-3)がその受容体だった。
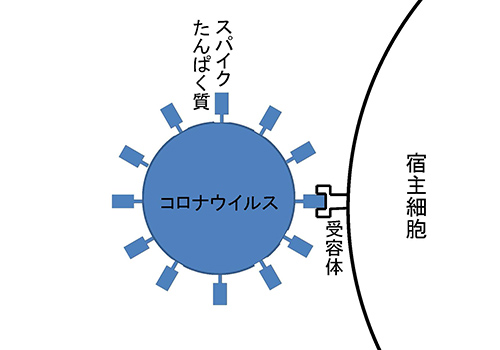
図12-9にSLAMのアミノ酸配列の中でヘマグルチニンとの相互作用に重要な35個のアミノ酸のうちで変異が見られる個所を示した(9)。
ラッコとアザラシは同じ食肉目の中の鰭脚上科とイタチ上科という一番近縁なグループ(姉妹群という)に属していて、この図で示したSLAMのアミノ酸はすべて一致しているので、アザラシジステンパーウイルスが同じように感染し得るものと考えられる。
先に、1987年に多数のバイカルアザラシがイヌジステンパーウイルス感染症により死亡したことを紹介した。その後、2000年にはロシア、カザフスタン、トルクメニスタン、イラン、アゼルバイジャンに囲まれた塩湖であるカスピ海に固有のカスピカイアザラシ(図12-10)がおよそ1万匹死亡するということが起こった。

この大量死には、さまざまな原因が考えられているが、イヌジステンパーウイルス感染が大きな比重を占めていることは確かである(10)。イヌジステンパーウイルスがなぜバイカルアザラシやカスピカイアザラシに感染して重篤な病気を引き起こすのか、その理由はまだ十分には解明されていない。
カスピカイアザラシに感染して大量死を引き起こしたジステンパーウイルスは確かにイヌジステンパーウイルスであるが、イヌジステンパーウイルスの系統樹の根元近くから派生した独自の系統だという研究がある(11)。ほかのイヌジステンパーウイルス株とは違っているのだ。宿主指向性を決めるヘマグルチニンに特有の変異が起こっていてアザラシに感染しやすくなっているのかもしれない。そうだとすると、そのようなイヌジステンパーウイルスの変異体は、もはやイヌには感染しにくくなっているであろう。アザラシジステンパーウイルスは、遠い昔にこれに似た過程を経てイヌジステンパーウイルスから進化したのかもしれない。
イヌジステンパーウイルスはさまざまな哺乳類に感染することが知られている(12)。ハムスターなどのげっ歯類、オナガザル科の霊長類、ブタ、ゾウ、アリクイなど食肉類以外にも感染する。また図12-9によると、同じ食肉類でもライオンのSLAMはイヌのものにくらべてアミノ酸配列がかなり違っているので、ウイルスは感染しにくいように思われる。ところが1994年以降、東アフリカのセレンゲティ国立公園とマサイマラ国立保護区ではイヌジステンパーウイルス感染によるライオンの大量死が起こっている。このウイルスでは宿主細胞表面のSLAMと相互作用するヘマグルチニン遺伝子の変異率が特に高く、そのような変異がこのウイルスが新たな宿主を開拓することに貢献しているように思われる。
最近懸念されていることに、イヌジステンパーウイルスの感染がヒト以外の霊長類で確認されていることである(8)。2006年に中国広西チワン族自治区で実験用動物として供給するために飼育されていたアカゲザル(図12-11)3万匹あまりのうちの1万匹がこれに感染し、そのうち4,250匹が死亡した (13)。

これまではモルビリウイルスの中では麻疹ウイルスだけがヒトに感染するといわれていたが、それに加えてヒトに対する新たな脅威が出現する可能性があるのだ。これがヒトのパンデミックにつながらないよう監視を続ける必要がある。
アカゲザルの事例はたくさんの動物を密集した状態で飼育することは、思いがけない感染症を引き起こす恐れがあることを示している。同じようなことはヨーロッパで毛皮用に大量に飼育されているミンク農場でSARS-CoV-2が流行し、それがまたヒトにも感染していることでも見られる(14)。2020年11月には、デンマーク政府が国内のおよそ1700万匹にのぼるミンクの殺処分を検討しており、実際に285万匹が殺処分されたというニュースも流れた。
1. Härkönen, T. et al. (2006) A review of the 1988 and 2002 phocine distemper virus epidemics in European harbour seals. Dis. Aquat.Org. 68, 115-130.
2. Hammond, J.A. et al. (2005) Identification and real-time PCR quantification of Phocine distemper virus from two colonies of Scottish grey seals in 2002. J. Gen. Virol. 86, 2563-2567.
3. Dietz, R., Ansen, C.T., Have, P. (1989) Clue to seal epizootic? Nature 338, 627.
4. Markussen, N.H., Have, P. (2009) Phocine distemper virus infection in harp seals Phoca groenlandica. Marine Mamm. Sci. 8, 19-26.
5. Goldstein, T. et al. (2009) Phocine distemper virus in northern sea otters in the Pacific Ocean, Alaska, USA. Emerg. Infect. Dis. 925-927.
6. VanWormer, E. et al. (2019) Viral emergence in marine mammals in the North Pacific may be linked to Arctic sea ice reduction. Sci. Rep. 9, 15569.
7. Fujii, K. et al. (2006) Seroepidemiological survey of morbillivirus infection in Kuril harbor seals(Phoca vitulina stejnegeri)of Hokkaido, Japan. Jpn. J. Vet. Res. 54, 109-117.
8. Kennedy, J.M. et al. (2019) Canine and phocine distemper viruses: global spread and genetic basis of jumping species barriers. Viruses 11, 944.
9. Ohishi, K. et al. (2019) Marine morbilliviruses: diversity and interaction with signaling lymphocyte activation molecules. Viruses 11, 606, doi:10.3390/v11070606.
10. Kuiken, T. et al. (2006) The 2000 canine distemper epidemic in Caspian seals (Phoca caspica): pathology and analysis of contributory factors. Vet. Pathol. 43, 321-338.
11. Jo, W.K. et al. (2019) The canine morbillivirus strain associated with an epizootic in Caspian seals provides new insights into the evolutionary history of this virus. Viruses 11, 894.
12. Duque-Valencia, J. et al. (2019) Evolution and interspecies transmission of canine distemper virus—an outlook of the diverse evolutionary landscapes of a multi-host virus. Viruses 11, 582.
13. Qiu, W. et al. (2011) Canine distemper outbreak in rhesus monkeys, China. Emerg. Infect. Dis. 17, 1541-1543.
14. Oude Munnink, B.B. et al. (2020) Transmission of SARS-CoV-2 on mink farms between humans and mink and back to humans. Science 10.1126/science.abe5901.
*もっと「進化」について知りたい人の入門書:
☆本連載が本になりました!
長谷川政美著『ウイルスとは何か:生物か無生物か、進化から捉える本当の姿』 (中公新書)。ウイルスは恐ろしい病原体か、あらゆる生命の源か――。進化生物学の最前線から、その正体に迫る。

☆いちばん新しい本!
長谷川政美著『進化生物学者、身近な生きものの起源をたどる
』 (ベレ出版)。 イヌやネコやクマなど身近な生き物はすべて進化していまここにいる。もちろんヒトも。生き物の進化が一目でわかる「系統樹マンダラ」を多数掲載(系統樹の「見方」付き)。ささやかな「現代版 種の起原」ができました。

☆はじめの一冊にオススメ!
長谷川政美監修・畠山泰英構成『世界でいちばん素敵な進化の教室
』 (三才ブックス)。 本書は美しい写真とQ&A形式の簡潔な文章で、38億年におよぶヒトを含む生き物の進化を解説した超入門ビュアルブックです。子供から大人まで気軽に楽しんでいただけます。
4刷(2022年10月)。






