いま世界に拡がるウイルスは、
リアルタイムで追跡できるほど進化が速い。ウイルスはいわゆる生物ではないが、
私たちヒトを含む生物と共進化する存在だ。
世界的な分子系統学者である著者が、
躍動感みなぎる“進化の舞台”へ読者を誘う。

著者プロフィール
長谷川政美(はせがわ まさみ)
1944年生まれ。進化生物学者。統計数理研究所名誉教授。総合研究大学院大学名誉教授。理学博士(東京大学)。著書に『分子系統学』(岸野洋久氏との共著)『DNAに刻まれたヒトの歴史』(共に岩波書店)、『系統樹をさかのぼって見えてくる進化の歴史』(ベレ出版)、『世界でいちばん美しい進化の教室』(監修、三才ブックス)、『共生微生物からみた新しい進化学』(海鳴社)、『進化38億年の偶然と必然』(国書刊行会)など多数。1993年に日本科学読物賞、1999年に日本遺伝学会木原賞、2005年に日本進化学会賞・木村資生記念学術賞など受賞歴多数。全編監修を務める「系統樹マンダラ」シリーズ・ポスターの制作チームが2020年度日本進化学会・教育啓発賞を受賞。

ウイルスという存在
ーヒトの進化にどうかかわってきたのかー
第15話
微生物叢が作るわが内なる小宇宙
文と写真 長谷川政美
ヒトのからだを作り上げている細胞の数はおよそ37兆個であるが、一人のヒトの腸内に生息する細菌の総数はこれを超える。さらに腸内細菌叢を構成する細菌のもつ遺伝子の数は、ヒト・ゲノムの遺伝子数の400倍くらいになる。これらの遺伝子の中には、ヒト・ゲノムにはないが、われわれが生きていく上で必要な代謝などをつかさどるものがたくさん含まれている (1)。実験室で抗生物質を使って体内の細菌をすべて取り除いて無菌にしたマウスがある。無菌の母親から産まれた無菌マウスは無菌の環境で育てる限りは育つが、そのような環境では免疫系が正常に発達しないので、通常は無害の細菌であっても、感染すると死んでしまう。さらにそのようなマウスでは、不安や感情に関わるセロトニンやドーパミンなどの脳内物質の量が少なくなり、行動に異常が見られる。正常な発育には細菌叢の存在が必要なのだ。
このように、われわれが体内に抱えている細菌叢は、われわれが健康に生きていく上で欠かせない働きをしているのである。われわれの体内には細菌だけではなく、ウイルスもたくさんいる。多様な細菌のそれぞれを宿主とするウイルスであるファージとわれわれの細胞を宿主とするウイルスたちである。これらのウイルスについてはまだ研究が始まったばかりであるが、腸内細菌と同じようにわれわれが生きていく上で重要な働きをしているものがたくさん含まれている可能性がある。
そのような可能性の一つとして、共生しているウイルスがいるとほかのウイルスの感染を防ぐ効果があるということが挙げられる。例えば一つの細胞に2種類のウイルスが感染すると、ウイルス同士の競合が起きる。長い共生の歴史を通じて安定した関係を築き上げたウイルスにとって、宿主を守ることは自分の利益にもなる。多様なウイルスがコウモリを宿主としているが、ほとんどのものはコウモリに対しては病原性を示さない。そのようなコウモリであっても、まったく新しいウイルスに感染したら、重篤な病気になりそうに思われるが、それが稀なのだ。コウモリと共生している多様なウイルスが、ほかのウイルスから宿主を守っているのかもしれない。
ヒトのからだは、ウイルスを含む膨大な数の微生物が作り上げている一つの生態系なので、微生物の間にはさまざまな相互作用がある。腸内細菌叢のいわゆる善玉菌が悪玉菌が悪さをするのを防いでいるといわれているが、ウイルスの間でも似たようなことがあるのかもしれない。
◎ほかの病原体の侵入を防ぐウイルス
1917年、当時パリのパスツール研究所で研究していたカナダ人微生物学者フェリックス・デレーユ(図15-1)は、細菌に感染するウイルスであるバクテリオファージ(単にファージともいう)を発見した。

この成果の短報の表題は「赤痢菌に拮抗する不可視微生物について」だった(2)。デレーユは細菌性赤痢に感染した回復期の患者の便から、赤痢菌の細胞内に感染するウイルスを発見したのだ。しかも、そのウイルスが赤痢菌の増殖を抑えているというのだ。
このファージは実際に赤痢患者に投与され、1日に10回以上も血便のあった患者の症状が翌日には直ってしまったなど、劇的な効果を示した。この治療法はファージ療法と呼ばれ、デレーユはノーベル賞の候補にもなり、脚光を浴びた。
ところがその後、抗生物質が華々しく登場した結果、ファージ療法は廃れてしまった。近年、抗生物質にはそれに抵抗性をもった細菌の出現とともに、抗生物質の多くが特定の病原菌だけを退治するのではなく、ヒトにとって有用な細菌も一緒に除去してしまうことが問題になっている。
ファージの多くは特定の細菌にしか感染しないので、特定の病原菌に感染するファージがあれば、ほかの細菌にはダメージを与えることなく病原菌を退治できることになる。デレーユが100年ほど前に提唱したファージ療法が再び脚光を浴びている(3)。
◎寄生バチとそれと共生するウイルスの複雑な関係
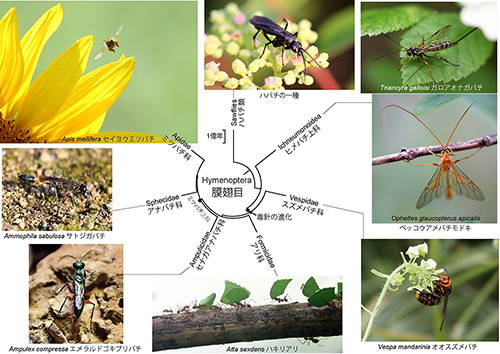
昆虫はこれまでに記載された種数に関してはあらゆる生物の中で最大のグループである。その中にハチやアリのグループの膜翅目がある。膜翅目には7万を超える種が記載されている。図15-2に膜翅目の系統樹マンダラを示した。
アリやミツバチは女王を中心とした社会を作るが、アリは膜翅目の中で高度の社会性を進化させたミツバチ上科に近い祖先から進化した。一方、膜翅目進化の初期に分岐したグループにヒメバチ上科(Ichneumonoidea)がある。このグループの大部分は寄生バチと呼ばれ、昆虫やクモなどの節足動物に寄生する。この系統にはおよそ2億年の歴史があり、これまでに記載されたものだけでも膜翅目全体の半数を超える48,000種以上にのぼる。現在までに記載されている生物種はおよそ200万種だから、ヒメバチ上科だけで生物界全体の2.4%にもなる(5)。ヒメバチ上科にはヒメバチ科(Ichneumonidae)とコマユバチ科(Braconidae)というどちらも大きな科が含まれる。
これらの寄生バチにはポリドナウイルス(Polydnavirus)というウイルスが感染する。このウイルスのゲノムは二本鎖DNAであるが、真核生物の染色体のように、たくさんのDNA分節に分かれている。ポリドナウイルスという名前は、Poly-DNA virus、つまりこのウイルスゲノムがたくさんのDNA分節から成っていることを表わしている。ポリドナウイルスの中でヒメバチ科を宿主とするものはイクノウイルス(Ichnovirus)、コマユバチ科のものはブラコウイルス(Bracovirus)と別の名前で呼ばれるが、実はこの2種類のウイルスはゲノムがたくさんのDNA分節から成っていることだけが共通で、その起源は別々である(6)。この2種類のウイルスの遺伝子の間で相同性がほとんど見られないのだ。
どちらのポリドナウイルスも寄生バチの卵巣と側輸卵管の間に位置するカリックスという特別の細胞内でのみ増殖する。ところがこのウイルスは再感染によって次世代に伝わっているのではなく、ハチのゲノムに組み込まれていて、生殖細胞を通して次世代に伝わるのだ(7)。このようにウイルスが宿主のゲノムに組み込まれることを、「内在化」という。この連載のあとのほうで、RNAウイルスの内在化とそれが宿主の進化に果たす役割について詳しく論じるが、今回はヒメバチ上科の寄生バチに内在化しているポリドナウイルスを紹介する。
コマユバチ属(Cotesia)のさまざまな種と共生するポリドナウイルスの系統樹と宿主の系統樹をくらべると両者は完全に一致することが分かる(8)。つまり、宿主の種分化にあわせてウイルスも一緒に種分化してきた共進化が見られるのだ。同じヒメバチ上科でもヒメバチ科とコマユバチ科に共生するポリドナウイルスは別々の起源をもつが、それでもそれぞれの科の歴史には1億年くらいの長さがある。コマユバチ科寄生バチを宿主とするブラコウイルスとヒメバチ科を宿主とするイクノウイルスは、それぞれ1億年くらいの期間、宿主の側の種分化にあわせて共進化してきた可能性がある。
ヒメバチ上科の寄生バチは、さまざまな昆虫やクモに寄生する。その中でヒメバチ科の一種のベッコウアメバチモドキ(図15-3)は、ヤママユ(図15-4)という蛾の幼虫の体内に産卵し、そこで孵化した幼虫は、ヤママユの幼虫から栄養を摂取しながら育つ。



ヒメバチ科の寄生バチの多くは、蛾や蝶などの幼虫、いわゆるイモムシに寄生し、寄主を内側から食べながら育つが、寄主が死んでしまったら腐るので、自分が成長するまでは生きた状態に保つ。イモムシが生きながらえたまま、体内を食べられるというのはとても残酷に見える。
チャールズ・ダーウィンもヒメバチのことを知っており、彼は1860年にエイサ・グレイに宛てた手紙の中で、「慈悲深い全知全能の神が、ヒメバチ科の寄生バチを創造なされたとは、私にはとても思えない」と書いている。
実は寄生バチの幼虫がこのように「残酷な」方法で成熟できるのは、ハチを宿主とするウイルスのおかげなのである。
ベッコウアメバチモドキはヒメバチ科なので、ポリドナウイルスの中のイクノウイルスが寄生している。このウイルスは内在化していてハチのゲノムの一部として次世代に伝わっていくが、ハチに対しては全く毒性を示さない。一方、寄生バチの宿主である蛾の幼虫の生理状態をコントロールすることによって寄生バチに恩恵を与えている(7)。
まず寄生バチの卵表面がメス蜂のカリックス細胞で増殖したポリドナウイルス粒子で覆われていることで、これが蛾の幼虫の免疫を回避する働きをする。ポリドナウイルスは内在化した状態で子供に受け渡されると同時に、ウイルス粒子として蛾の幼虫の体内に入り、寄生バチを排除しようとする免疫機構から逃れる役割も果たしている。
さらに、ポリドナウイルスはヤママユの幼虫のホルモン系を攪乱して、蛹化することを妨げる。寄生バチの幼虫は成熟すると寄主の体表を破って出てきて蛹になるが、寄主が先に蛹になってしまうと体表が硬くなって破れなくなってしまうのである。ポリドナウイルスは直接の宿主である寄生バチの幼虫が安定した新鮮な食糧庫の中で無事に成長できるようにヤママユの幼虫をコントロールしているのだ。
このように、宿主がウイルスを利用して自身の生き残りを図っているように見えることを、「ウイルスの家畜化」(Viral domestication)という(9)。
◎寄生バチの宿主にも内在化したポリドナウイルス
寄生バチの宿主となるカイコガなどの蛾のゲノムにポリドナウイルスの配列が組み込まれていることが発見された (10)。内在性ウイルス様配列である。ハチの寄生がいつも首尾よく成功すれば、蛾の幼虫が成虫になるまで生き延びることはないので、ウイルスの配列が蛾のゲノムに組み込まれることはなさそうである。しかし、ハチの寄生が成功するためには、そのタイミングが大事である。蛾の幼虫の発生初期に卵が産みつけられるとうまくいくが、それが遅くなってしまうと寄生は失敗してしまう。そのような場合に、ウイルスの配列が蛾のゲノムに組み込まれるということが起こりうるのだ。
内在化された配列がウイルスの2次的な宿主である蛾にとって何かの役に立っているかどうかについては、これまでのところ分かっていない。可能性としてはさまざまなことが考えられるが、組み込まれたウイルスの配列が転写されて発現することによって、新たなウイルス感染で作られる伝令RNA(mRNA)と複合体を作り、ウイルス遺伝子の発現を妨げるということもあり得る。
昆虫やエビなどの甲殻類では、ある種のウイルスは強い病原性を示すが、一方で一生の間なんら症状を示すことなくウイルスを持ち続ける個体もいる。実は、そのようなウイルスのゲノムの一部が、宿主のゲノムに組み込まれていることが分かっている。これらの事実から、上で述べたような仮説が提唱されているのである(11)。
つまり、宿主はウイルスのゲノムを盛んに自分自身のゲノムに取り込み、それをRNAとして発現させることにより、それと相補的な外来ウイルスの伝令RNAと結合させ、結果的に免疫の役目を果たさせているという仮説である。
そのような外来性ウイルスに対する防御機構は、コウモリなどでも提唱されている(12)。前回(第14話)、哺乳類の中でコウモリが特別に多様なウイルスをもっているにも関わらず、ほとんど病症を示さないことを紹介した。実はコウモリのゲノムは、サイズが小さいにも関わらず、多様な内在性ウイルス様配列をもっている。そして、内在性ウイルス様配列が外来性ウイルスの増殖を抑える働きをしているというのである。大きな集団を作って、ウイルスにとって増殖しやすい環境を提供しているコウモリも、さまざまな方法でウイルスに対処しているのだ。
1. 長谷川政美(2020)『共生微生物からみた新しい進化学』海鳴社.
2. Roux, M. (2011) On an invisible microbe antagonistic to dysentery bacilli. Note by M.F. d’Herelle, presented by M. Roux. Comptes Rendus Academie des Sciences 1917; 165:373–5, Bacteriophage 1, 3-5.
3. Fruciano, D.E., Bourne, S. (2007) Phage as an antimicrobial agent: d’Herelle’s heretical theories and their role in the decline of phage prophylaxis in the West. Can J. Infect. Dis. Med. Microbiol. 18(1), 19-26.
4. Branstetter, M.G. et al. (2017) Phylogenomic insights into the evolution of stinging wasps and the origins of ants and bees. Curr. Biol. 27, 1019-1025.
5. Sharanowski, B.J. et al. (2020) Phylogenomics of Ichneumonoidea (Hymenoptera) and implications for evolution of mode of parasitism and viral endogenization. Mol. Phylogen. Evol. https://doi.org/10.1016/j.ympev.2020.107023.
6. Strand, M.R., Burke, G.R. (2012) Polydnaviruses as symbionts and gene delivery systems. PLoS Pathog. 8(7), e1002757.
7. 早川洋一(1998)寄生バチとポリドナウイルスの関係.ウイルス48(1), 67-72.
8. Whitfield, J.B., O’Connor, J.M. (2012) Molecular systematics of wasp and polydnavirus genomes and their coevolution. In “Parasitoid Viruses: Symbionts and Pathogens” (eds. Beckage, N.E., Drezen, J.-M.), pp. 89-97, Academic Press.
9. Leobold, M. et al. (2018) The domestication of a large DNA virus by the wasp Venturia canescens involves targeted genome reduction through pseudogenization. Genome Biol. Evol. 10(7), 1745-1764.
10. Schneider, S.E., Thomas, J.H. (2014) Accidental genetic engineers: horizontal sequence transfer from parasitoid wasps to their lepidopteran hosts. PLoS ONE 9(10), e109446.
11. Flegel, T.W. (2009) Hypothesis for heritable, anti-viral immunity in crustaceans and insects. Biology Direct 4, 32.
12. Skirmuntt, E.C. et al. (2020) The potential role of endogenous viral elements in the evolution of bats as reservoirs for zoonotic viruses. Annu. Rev. Virol. 7, 12.1–12.17.
*もっと「進化」について知りたい人の入門書:
☆本連載が本になりました!
長谷川政美著『ウイルスとは何か:生物か無生物か、進化から捉える本当の姿』 (中公新書)。ウイルスは恐ろしい病原体か、あらゆる生命の源か――。進化生物学の最前線から、その正体に迫る。

☆いちばん新しい本!
長谷川政美著『進化生物学者、身近な生きものの起源をたどる
』 (ベレ出版)。 イヌやネコやクマなど身近な生き物はすべて進化していまここにいる。もちろんヒトも。生き物の進化が一目でわかる「系統樹マンダラ」を多数掲載(系統樹の「見方」付き)。ささやかな「現代版 種の起原」ができました。

☆はじめの一冊にオススメ!
長谷川政美監修・畠山泰英構成『世界でいちばん素敵な進化の教室
』 (三才ブックス)。 本書は美しい写真とQ&A形式の簡潔な文章で、38億年におよぶヒトを含む生き物の進化を解説した超入門ビュアルブックです。子供から大人まで気軽に楽しんでいただけます。
4刷(2022年10月)。