いま世界に拡がるウイルスは、
リアルタイムで追跡できるほど進化が速い。ウイルスはいわゆる生物ではないが、
私たちヒトを含む生物と共進化する存在だ。
世界的な分子系統学者である著者が、
躍動感みなぎる“進化の舞台”へ読者を誘う。

著者プロフィール
長谷川政美(はせがわ まさみ)
1944年生まれ。進化生物学者。統計数理研究所名誉教授。総合研究大学院大学名誉教授。理学博士(東京大学)。著書に『分子系統学』(岸野洋久氏との共著)『DNAに刻まれたヒトの歴史』(共に岩波書店)、『系統樹をさかのぼって見えてくる進化の歴史』(ベレ出版)、『世界でいちばん美しい進化の教室』(監修、三才ブックス)、『共生微生物からみた新しい進化学』(海鳴社)、『進化38億年の偶然と必然』(国書刊行会)など多数。1993年に日本科学読物賞、1999年に日本遺伝学会木原賞、2005年に日本進化学会賞・木村資生記念学術賞など受賞歴多数。全編監修を務める「系統樹マンダラ」シリーズ・ポスターの制作チームが2020年度日本進化学会・教育啓発賞を受賞。

ウイルスという存在
ーヒトの進化にどうかかわってきたのかー
第17話
アルボウイルスの正体
―節足動物媒介性ウイルス
文と写真 長谷川政美
これまで紹介してきたヒトにも感染するウイルスは、コウモリなど哺乳類を自然宿主とするものが主だった。今回は、昆虫など節足動物が媒介するアルボウイルスを紹介しよう。この名前は、Arthropod- borne virus(節足動物媒介性ウイルス)からきている。アルボウイルスの中でヒトにとって一番問題になるのが蚊の媒介するものである。人類の歴史を通じて、蚊が媒介するヒト感染症のうちで一番恐れられてきたのはマラリアであろう。マラリア病原体はウイルスではなく、マラリア原虫という真核生物である。ハマダラカが媒介するこの感染症は、2016年の1年間でも世界で2億1600万人の新規感染者が報告され、44万5000人が死亡している(1)。
蚊が媒介するウイルスによるヒト感染症には、デング熱、ジカ熱、黄熱病、日本脳炎、西ナイル熱脳炎、セントルイス脳炎などがあるが、これらはそれぞれ、デングウイルス、ジカウイルス、黄熱ウイルス、日本脳炎ウイルス、西ナイルウイルス、セントルイスウイルスが病原体になっている。これらはすべてフラビウイルス科フラビウイルス属(Flavivirus)のウイルスである。フラビウイルスは一本鎖プラス鎖RNAウイルスである。
◎西ナイル熱脳炎
1999年にニューヨークのブロンクス動物園の近くで大量のカラスが死んだ。空を飛んでいたカラスがバランスを失って雨のように降ってきたという(2)。死んだカラスを解剖すると、脳に出血を伴った炎症が見つかった。さらにブロンクス動物園では、フラミンゴ、ウ、キジ、ハゲワシなどの鳥類が死んだ。死んだ鳥には脳炎と心筋炎などの病変が見られた。解析の結果、原因はフラビウイルス属のウイルスによるものであることが明らかになった。
その頃、ニューヨークでは脳炎患者の集団発生が起きていた。最初これは蚊によって媒介されるフラビウイルス科のセントルイスウイルスによるセントルイス脳炎と思われた。患者からセントルイスウイルスに対するIgMタイプの抗体(感染の初期に見られる抗体)が見つかったからである。このウイルスは名前が示すように、1933年にアメリカ・ミズーリ州のセントルイスではじめて分離されたものであり、アメリカ南東部でしばしば流行していたものであった。
ところがさらに詳しくウイルスのゲノムを調べてみると、セントルイスウイルスではなく、それと近縁なアフリカ起源の西ナイルウイルスだということが分かった。セントルイスウイルスではなかったが、近縁なウイルスだったために、同じような抗体ができたのだ。カラスなどの鳥が死んだ原因も同じウイルスだった。
紀元前323年にマケドニアのアレクサンダー大王はインドまでの東方遠征の帰路、メソポタミアのユーフラテス川沿いのバビロンで熱病のために亡くなった。死因はマラリアだったというのが通説だが、西ナイル熱だったのかもしれないという説がある(3)。帝政ローマ時代のギリシア人プルタルコスの『英雄伝』によると、アレクサンダー大王の軍がバビロンに入るときに何羽かのカラスが大王の足元に落ちたという。まさに1999年にニューヨークで起ったのと似たことが起こったのだ。
西ナイルウイルスは1937年にアフリカ・ウガンダの西ナイル地方で発熱した患者からはじめて分離されたが、アメリカで確認されたのは1999年が最初だった。その後2003年までにはこのウイルスはアメリカ合衆国全土(アラスカ州とハワイ州を除く48州)、さらにカナダ、ラテンアメリカにも拡がった。2007年までにアメリカ合衆国だけで2万7000人以上の患者が報告された。
図17-1に分子系統樹解析で得られた西ナイルウイルスの系統樹を示す(4)。
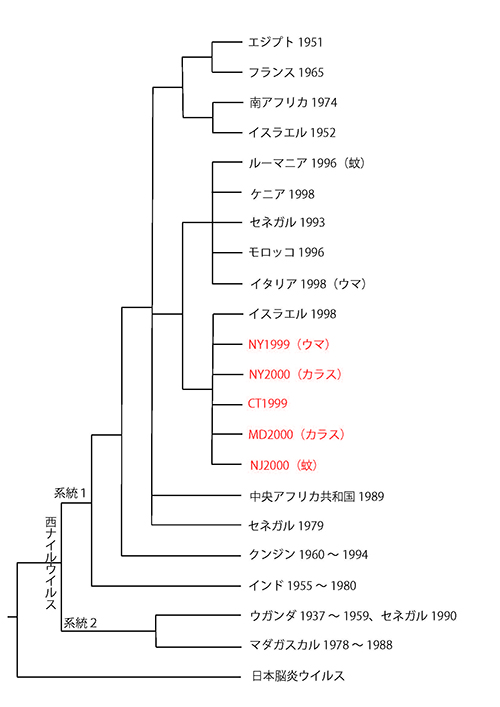
その中でアメリカ合衆国で採取された株は赤字で示したが、それに近縁な株がイスラエルで見つかっている。このウイルスはもともとアフリカのものであるが、それがヨーロッパや中東に伝わり、そこからアメリカに伝わった。アメリカで最初に確認される前年の1998年にイスラエルで西ナイル熱の流行があったので、そこからアメリカに伝わったものと考えられる。
このウイルスには系統1と系統2という2つの系統があるが、アメリカに伝わったのは系統1である。系統1はヒトに病原性を示すが、一方、系統2はヒト以外の動物に病原性を示すものの、ヒトに対する病原性は低く脳炎を発症させることはないという(5)。アメリカ合衆国の統計では、2006年までの西ナイル熱脳炎の致死率は9.6%に達した。
このウイルスは、自然界では主にスズメ目の野鳥と蚊の間を循環するが、それがヒトやウマなどさまざまな哺乳動物にも流出(spillover)して重篤な病気を引き起こす。アメリカ南東部の都市アトランタではスズメ目の野鳥のおよそ30%が西ナイルウイルスに対する抗体を保有しているが、ヒトへの感染率は低い(1年あたり10万人当たり3.3人)。
一方、アメリカ北東部のシカゴでの野鳥の抗体保有率は18.5%とアトランタよりも低いにもかかわらず、ヒトへの感染率がアトランタの5倍にもなる(10万人当たり16.2人)(6)。二つの都市におけるこの違いは何によるのであろうか。
アトランタでさまざまな野鳥の抗体保有率を調べてみると、ショウジョウコウカンチョウ(図17-2)の保有率がほかの鳥にくらべて有意に高くなっているという。

ところが、ショウジョウコウカンチョウの体内ではウイルスの増殖率が低く、その血液を蚊が吸ってもあまり効率よくほかの動物に感染させられないのだという。つまり、結果的にショウジョウコウカンチョウがヒトへの感染を抑制しているというのだ。アトランタで見られるマネシツグミ(図17-3)もまた、同じようにヒトへの感染を抑制している可能性があるという(6)。

アメリカでの感染は主にイエカ属(Culex)の蚊が媒介する(図17-4)。蚊が吸った血液に含まれるDNAを分析すると、どの種の鳥の血を吸ったかが分かる。アメリカ北東部のコネチカット州での調査によると、イエカが吸う血液の大半はコマツグミ(図17-5)からだという(7)。


従って、コマツグミが西ナイルウイルスのスーパースプレッダーと考えられる。
南東部のアトランタの蚊もコマツグミの血を吸うが、それは5月から7月中旬までであり、西ナイル熱が流行する7月中旬以降になると、どうゆうわけかコマツグミの血をあまり吸わなくなり、代わりにショウジョウコウカンチョウの血を吸うようになるという(6)。シカゴにもコマツグミとショウジョウコウカンチョウは分布しているので、アトランタでシカゴにくらべて西ナイル熱の感染率が低い理由は依然として不明な部分があるが、二つの都市の環境の違いが関係しているのかもしれない。アトランタでは市街地の40%以上が古い樹木で覆われているのに対して、シカゴでは樹木で覆われている土地は11%に過ぎない。このような違いが蚊の吸血行動に影響を与えているのかもしれない。
しかしながら、ショウジョウコウカンチョウが西ナイル熱のヒトへの感染を抑える働きをしているという説に対しては異論もあり、まだ不明なことが多い(8)。
◎フラビウイルス属の進化
図17-6にフラビウイルス属の系統樹を示す(9)。
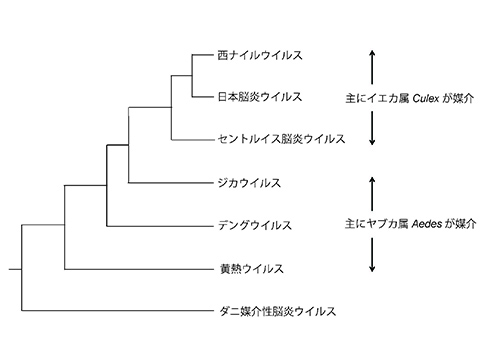
西ナイルウイルスやセントルイス脳炎ウイルスなどを含む日本脳炎グループは主にイエカ属の蚊によって媒介されるが、ジカウイルス、デングウイルス、黄熱ウイルスなどは主にヤブカ属(図17-7)によって媒介される。これらのウイルスは、共通の祖先から進化したのである。

黄熱病はアフリカと南アメリカの熱帯から亜熱帯の地域で現在でも流行が続いている。20世紀初頭に野口英世によって研究が手がけられたものの、彼は研究の中途でこれに感染して亡くなった。その当時ウイルスというものがよく分かっていなかったので野口の研究は挫折したのだ。
2016年の段階でも、アフリカや南アメリカでは毎年10万人ほどの感染者がいると推定されている(10)。現在安全性の高いワクチンが開発されており、流行が続いている国の中には、入国に際して予防接種証明書の提示を義務付けている国もある。
2014年8月に、海外渡航歴がなく東京都の代々木公園で蚊に刺されたひとからデング熱が発生し大きな問題になった。デングウイルスは日本の公園にもよくいるヤブカ属のヒトスジシマカ(図17-7)によって媒介される。デングウイルスに感染しても8割は無症状であり、それ以外もたいていは軽症ですむ。ところが、ときには重篤な症状に陥ることがある。
第5話で紹介したが、デングウイルスには4種類の型があり、そのうちの一つの型に感染して治ったひとは、その型のウイルスに対しては免疫をもつが、別の型のウイルスに再感染すると、はじめてのひとよりもはるかに重篤になることがあるという。このような現象は最初の感染で得られた抗体が十分な働きをしないために起きる抗体依存性感染増強ADEによると考えられる。
2013年の推定によると、世界中でデングウイルスに感染する人は年間3億9000万人に達し、そのうち9600万人が症状を示し、数万人が亡くなるという(11)。蚊が媒介する感染症は、熱帯地方の国々では現在でも深刻な問題になっているのである。
◎蚊の共生細菌を使った感染症制御
多くの節足動物の細胞内にボルバキア(Wolbachia)という真正細菌が共生する。これは通常、卵子を通じて母親から子供に伝達される。ボルバキアに関わるさまざまな話題は拙書(12)で紹介したが、これを使ってデングウイルスなど節足動物媒介性ウイルスによる感染症を制御しようとする試みがある(13,14)。
人類は病原体を媒介する昆虫や農作物に被害を与える害虫を駆除する方法をいろいろ編み出してきた。殺虫剤散布や、蚊の場合は水溜まりをなくすなどの方法が使われてきたが、なかなか完全な駆除にまでは至らない。特に殺虫剤はそれに耐性をもった変異個体の出現や、生態系に対する悪影響が懸念される。その後、放射線などで不妊にしたオスを大量に放すことによって、交尾しても子供が生まれなくなって個体数が減少するという不妊虫放飼法が開発された。
沖縄でキュウリやゴーヤなどウリ類の害虫として農業に被害を与えたウリミバエがこの方法で駆除された(15)。しかし、沖縄のように孤立した島の場合はこの方法は有効だったが、大陸などではあまり現実的ではない。完全に駆除するまで、不妊化したオスを大量に放出し続けなければならず、コストも大変である。ボルバキアを使う方法は、蚊の個体数を減らそうというのではなく、感染症を媒介する蚊の能力を減らそうというものであり、新たな方法として期待されている。
ボルバキアが共生することが、宿主のウイルス感染症に対して抵抗力を与えるということは、キイロショウジョウバエ(Drosophila melanogaster)で知られていた(16)。
ボルバキアが共生していると、ショウジョウバエCウイルス、ノラウイルス、フロックハウスウイルスなどのRNAウイルスが感染しても、それらに対して抵抗性をもつという。病原性ウイルスに対する抵抗性は、宿主自身だけの問題だけではなく、体内のさまざまな微生物との相互作用によって決まっているのである。
われわれは自分自身を自立した生き物と考えがちであるが、免疫系はさまざまな微生物との相互作用の結果として成り立っているとともに、われわれの性格決定にさえも共生微生物が関与しているのである(12)。このことは、「自己とは何か」あるいは「自由意志はあるのか」という哲学的な問題を提起する。
共生体と宿主の関係は複雑であり、状況によってさまざまに変わるが、多くの場合、共生体にとっては宿主の健康を守るように働くことが自身の存続を助けることにつながるのであろう。あるいは、昆虫に共生するボルバキアがウイルスと共通の資源をめぐって競い合うために、結果的に宿主にウイルスに対する抵抗性をもたらすのかもしれない。
ヤブカ属のネッタイシマカ(Aedes aegypti)にボルバキアを共生させると、その機構はまだ明らかではないが、デングウイルスやジカウイルスの増殖が抑えられるという。ボルバキアを蚊の卵に感染させて共生個体を作りだし、それを野外に放すことによって、デング熱やジカ熱の流行を抑えようという試みが始まっている。
共生細菌ボルバキアは母親から子供に受け継がれるので、ボルバキアが共生した個体群を野外に放ち、共生体が蚊の集団内に広まっていくことで、蚊におけるデングウイルスやジカウイルスの感染率が低下することが期待されている。
蚊の一つの種を絶滅に追いやることは、その蚊が外来のものではなく長い間その地域の生態系の一員だった場合には、生態系に思いがけない影響を与えるかもしれない。ボルバキアを使った蚊の改変は、そのような影響を最小限に抑えながら、同時に感染症を抑えることにもなるであろう。しかしながら、ウイルスとのせめぎ合いはそこで終わりになるわけではない。
確かにボルバキアが共生した蚊ではデングウイルスやジカウイルスの増殖は抑えられるが、ウイルスの側もそのような抑制をうち破る能力を進化させるかもしれないのだ(17)。
1. サンドラ・ヘンペル(2020)『ビジュアルパンデミック・マップ ― 伝染病の起源・拡大・根絶の歴史』関谷冬華訳、日経ナショナルジオグラフィック社.
2. 山内一也(2020)『ウイルスの世紀 ― なぜ繰り返し出現するのか』みすず書房.
3. 加藤茂孝(2013)『人類と感染症の歴史』丸善出版.
4. Lanciotti, R.S. et al. (2002) Complete genome sequences and phylogenetic analysis of West Nile virus strains isolated from the United States, Europe, and the Middle East. Virology 298, 96-105.
5. 高崎智彦(2007)ウエストナイル熱・脳炎.ウイルス57, 199-206.
6. Levine, R.S. et al. (2016) Supersuppression: Reservoir competency and timing of mosquito host shifts combine to reduce spillover of West Nile virus. Am. J. Trop. Med. Hyg., 95, 1174-1184.
7. Simpson, J.E. et al. (2012) Vector host-feeding preferences drive transmission of multi-host pathogens: West Nile virus as a model system. Proc. Roy. Soc. B279, 925-933.
8. Kain, M.P., Bolker, B.M. (2019) Predicting West Nile virus transmission in North American bird communities using phylogenetic mixed effects models and eBird citizen science data. Parasites Vectors 12, 395.
9. Pierson, T.C., Lazear, H.M., Diamond, M.S. (2021) Flaviviruses: dengue, zika, West Nile, yellow fever and other flaviviruses. in “Fields Virology: Vol. 1. Emerging Viruses” (7th ed., eds. Howley, P.M., Knipe, D.M.), pp.345-409、Wolters Kluwer.
10. Shearer, F.M. et al. (2018) Existing and potential infection risk zones of yellow fever worldwide: a modelling analysis. Lancet Glob. Health 6, e270-78.
11. Bhatt, S. et al. (2013) The global distribution and burden of dengue. Nature 496, 504-507.
12. 長谷川政美(2020)『共生微生物からみた新しい進化学』海鳴社.
13. Flores, H.A.; O’Neill, S.L. (2018) Controlling vector-borne diseases by releasing modified mosquitoes. Nature Rev. Microbiol. 16, 508-518.
14. Callaway, E. (2020) The mosquito strategy that could eliminate dengue. Nature doi: 10.1038/d41586-020-02492-1.
15. 伊藤嘉昭(1980)『虫を放して虫を滅ぼす ― 沖縄・ウリミバエ根絶作戦私記』中央公論社.
16. Teixeira, L., Ferreira, A., Ashburner, M. (2008) The bacterial symbiont Wolbachia induces resistance to RNA viral infections in Drosophila melanogaster. PLoS Biol. 6(12), e1000002.
17. Yen, P.-S., Failloux, A.-B. (2020) A Review: Wolbachia-based population replacement for mosquito control shares common points with genetically modified control approaches. Pathogens 9, 404.
*もっと「進化」について知りたい人の入門書:
☆本連載が本になりました!
長谷川政美著『ウイルスとは何か:生物か無生物か、進化から捉える本当の姿』 (中公新書)。ウイルスは恐ろしい病原体か、あらゆる生命の源か――。進化生物学の最前線から、その正体に迫る。

☆いちばん新しい本!
長谷川政美著『進化生物学者、身近な生きものの起源をたどる
』 (ベレ出版)。 イヌやネコやクマなど身近な生き物はすべて進化していまここにいる。もちろんヒトも。生き物の進化が一目でわかる「系統樹マンダラ」を多数掲載(系統樹の「見方」付き)。ささやかな「現代版 種の起原」ができました。

☆はじめの一冊にオススメ!
長谷川政美監修・畠山泰英構成『世界でいちばん素敵な進化の教室
』 (三才ブックス)。 本書は美しい写真とQ&A形式の簡潔な文章で、38億年におよぶヒトを含む生き物の進化を解説した超入門ビュアルブックです。子供から大人まで気軽に楽しんでいただけます。
4刷(2022年10月)。





