いま世界に拡がるウイルスは、
リアルタイムで追跡できるほど進化が速い。ウイルスはいわゆる生物ではないが、
私たちヒトを含む生物と共進化する存在だ。
世界的な分子系統学者である著者が、
躍動感みなぎる“進化の舞台”へ読者を誘う。

著者プロフィール
長谷川政美(はせがわ まさみ)
1944年生まれ。進化生物学者。統計数理研究所名誉教授。総合研究大学院大学名誉教授。理学博士(東京大学)。著書に『分子系統学』(岸野洋久氏との共著)『DNAに刻まれたヒトの歴史』(共に岩波書店)、『系統樹をさかのぼって見えてくる進化の歴史』(ベレ出版)、『世界でいちばん美しい進化の教室』(監修、三才ブックス)、『共生微生物からみた新しい進化学』(海鳴社)、『進化38億年の偶然と必然』(国書刊行会)など多数。1993年に日本科学読物賞、1999年に日本遺伝学会木原賞、2005年に日本進化学会賞・木村資生記念学術賞など受賞歴多数。全編監修を務める「系統樹マンダラ」シリーズ・ポスターの制作チームが2020年度日本進化学会・教育啓発賞を受賞。

ウイルスという存在
ーヒトの進化にどうかかわってきたのかー
第8話
動物からはじまったウイルス感染症
文と写真 長谷川政美
「動物由来感染症」は、英語では「zoonosis」という。zoonosisは「動物の病気」というギリシャ語からきているが、ヒト以外の動物に寄生する病原体により生じるヒトの感染症ということである。◎コウモリを自然宿主とするウイルス
第6話で見たように、ヒトに感染するようになったコロナウイルス7種のうちの5種は、もともとコウモリを自然宿主とするものである。また風邪のウイルスとして知られているコロナウイルスのうちの残りの2種類はネズミなどげっ歯類由来のものであるから、これらのウイルスが引き起こす病気はすべて動物由来感染症だ。
1994年、オーストラリアでウマからヒトに感染して重篤な症状を引き起こしたヘンドラウイルス感染症のウイルスも、自然宿主はオオコウモリである。1998年にマレーシアの養豚場のブタとそこで働くヒトが重篤な脳炎に罹ったニパウイルス感染症もオオコウモリに由来する、ヘンドラウイルスと近縁なウイルスが引き起こしたものである。
ニパウイルス感染症により、マレーシアでは百万頭を超えるブタが殺処分され、養豚産業は壊滅的な打撃を受けたが、この感染症が発生したそもそもの原因は、オオコウモリの生息地に養豚場がつくられたことにあるようだ。マンゴーやドリアンなどの果物を求めて多くのオオコウモリ(図8-1)がやってくる場所に養豚場がつくられたために、コウモリとブタが接触するようになってしまった(1)。
マンゴー、バナナ、グアバなど熱帯の果実を実らせる樹には、オオコウモリに蜜を提供して受粉を助けてもらうものが多い。オオコウモリはまたそのような果実を食べ、種子を遠くまで運んで植物の分布を拡げることにも貢献している。そのような樹のある場所に養豚場が作られてしまったことが問題だったのだ。

動物由来感染症zoonosisは「動物の病気」というが、ヘンドラウイルス感染症の中間宿主であるウマや、ニパウイルス感染症の中間宿主のブタには重篤な病気を引き起こすものの、自然宿主のオオコウモリには目立った病原性を示さない。
ニパウイルス感染症はこれまでマレーシア、バングラデシュ、インドなどでの流行はあったが、幸い世界的な大流行パンデミックには至っていない。しかし、2015年12月にはWHOが近い将来にパンデミックを起こす恐れのある感染症の一つの候補として挙げている。
最初養豚場で発生したこの感染症は、ブタと接したヒトには感染したが、その家族には感染しなかったことから当初ヒトからヒトへの感染はないと考えられた。しかし、2019年に発表されたバングラデシュでのニパウイルス伝搬の調査によると、248のヒトへの感染例のうちの82例はヒト・ヒト感染だったという(1)。現代社会では、ウイルスがいったんヒト・ヒト感染の能力を獲得すれば、容易に世界中に拡散し得るのである。
ニパウイルスは、パラミクソウイルス科Paramyxoviridaeに属する一本鎖RNAウイルスであるが、コロナウイルスとは違ってゲノムはマイナス鎖RNAである。ニパウイルス感染症のヒトへの感染は最初1998年にマレーシアの養豚関係者の間で流行したが、その後、バングラデシュ、インドなどでも流行がみられた。
ところが、これらの感染者から採取されたウイルスのゲノムを調べてみると、かなり違った二つの系統に分類される(2)。マレーシアを中心に拡がったマレーシア系統とバングラデシュ、インドなどのバングラデシュ系統である。二つの系統ではゲノムがコードするたんぱく質のアミノ酸配列もかなり違っていた。
マレーシア系統ではブタを介した感染が主であるのに対して、バングラデシュ系統ではヒト・ヒト感染も多いなど、二つの系統の間には感染様式にも違いがある。ヒトに感染しやすくなるような変異も二つの系統で独立に進化したようなのである。二つの地域におけるオオコウモリの集団で、ヒトに感染しうるような変異がそれぞれ独立に生まれたものと考えられる。
このように野生動物を自然宿主とするウイルスの集団の中には、さまざまな変異を重ねながらヒトや家畜に感染する機会を待ちかまえているウイルスがいるのだ。
◎エボラウイルス
1967年にドイツのマールブルクで実験用に輸入されたアフリカミドリザル(図8-2)からヒトに感染したマールブルグ病や、1976年以来アフリカで何回も流行を繰り返しているエボラウイルス病(最初はエボラ出血熱と呼ばれたが、必ずしも出血の症状があるわけではないのでエボラウイルス病という)も、オオコウモリを自然宿主とするウイルスがヒトに感染するようになったものであると考えられた(3)。どちらもフィロウイルス科(Filoviridae)のウイルスが引き起こすものである。
フィロウイルスのfiloはラテン語で糸を意味するが、これはウイルス粒子が糸状の特異なかたちをしていることからきている。これらのウイルスはマイナス鎖一本鎖RNAゲノムをもつ。

エボラウイルス病に関しては、1976年のザイール(現在のコンゴ民主共和国)での最初の流行では、致死率が88%にも達した。その後2013年から2016年にかけての西アフリカ各国の大流行ではあわせて3万人近くが感染し、致死率は70~74%と推定された。
この時に採取された99のエボラウイルス株のゲノムを解析した論文が2014年にサイエンス誌に掲載されている(4)。この論文には58名の共同研究者が名前を連ねているが、論文が出版された時点でそのうちの6名が亡くなっている。まさに命がけの研究だった。
エボラウイルス病は1976年以来、コンゴ民主共和国などの中部アフリカやシエラレオネなどの西アフリカの諸国で10回以上にわたってヒトでの流行や終息を繰り返してきた。感染して死んだチンパンジーやゴリラの肉を食べるなどしてヒトに感染した例もあるが、もともとはオオコウモリからきたものであると考えられる(図8-3)。

図8-4はエボラウイルスのゲノムデータから描かれた系統樹である(4)。この図からは、1976年に最初にコウモリからの感染があって以降、ヒトや霊長類の集団で流行と終息を繰り返してきたエボラウイルスが、終息中もヒトや霊長類の集団に潜んでいて、それが活動を始めるようになって次の流行が起こるようになったと見ることもできる。しかし、この命がけの論文を書いた著者たちは、そうではなかったと考えている。
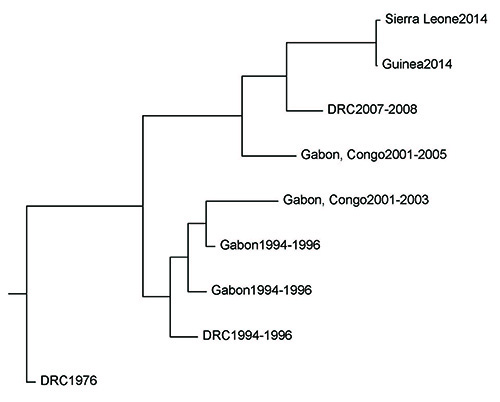
彼らの系統樹解析には、西アフリカのシエラレオネとギニアにおける2014年の流行期に採取した多くのウイルスのデータが入っている(図8-4ではそれぞれ一つに集約されているが)。これらシエラレオネとギニアの流行も、2008年のコンゴ民主共和国(DRC)での流行も、それぞれで見られるウイルスが非常に均質だったのである(ガボンとコンゴの2001~2005の流行では2つの異なる系統が見られるが)。
たいていの流行では、関与したウイルスの共通祖先はほとんどその流行で最初の感染が確認された直前だったと推測される。もしも密かに拡がっていたウイルスが一斉に活動しだしたのだとすると、それぞれの流行でもっと多様なウイルスが見られることが期待されるが、実際にはそうではなかったのだ。著者たちの結論は、大流行に際して、そのつどコウモリからの種の壁を超えた「spillover(流出)」が起こったのではないかという。
この解釈が正しいとすると、図8-4の系統樹のヒトでの流行を示す末端部以外の枝は、コウモリの集団中で密かに進行していた進化だったことになる。彼らの考えを証明するためには今後、野生のコウモリを宿主とするエボラウイルスを徹底的に調べ上げていくことが必要である。
最初エボラウイルスの自然宿主は果実食のオオコウモリだと考えられた。オオコウモリからヒトに直接感染したり、オオコウモリの食べ残した果実を食べたゴリラなどの大型動物を狩猟したヒトが感染したりすることは確かであるが、自然宿主はオオコウモリではなく、アンゴラオヒキコウモリという昆虫食のコウモリ(図8-5)だという説もある (5)。

◎野生動物からのウイルスの流出
コウモリの中にはミミナガホウヒゲコウモリのように単独生活をするものもあるが、洞窟や樹の洞などで群れを作って生活するものが多い。図8-3はそのような閉じた空間ではないが、マダガスカルオオコウモリが群れて休んでいる様子である。メキシコオヒキコウモリやジュフロワルーセットオオコウモリのように一つの群れで数百万匹にも達するものもある。タイのヒダクチオヒキコウモリ(図8-5)も一つの洞窟におよそ300万匹が群れで生息している。ペルーのある洞窟では、先住民の遺跡が19メートルの厚さに堆積したコウモリの糞の層の下から見つかったという。このような堆積したコウモリの糞を表す言葉として「chiropterite」があるが、人々がこのようなコウモリの糞(コウモリ・グアノ)を肥料として使ってきたことから特別に生まれた言葉であろう。
コウモリを自然宿主とするウイルスはたいてい宿主に対して目立った病原性を示すことなく宿主と平和的に共生している。ウイルスが宿主を殺してしまうようなことは、ウイルス自身の繁栄という面からも望ましい戦略ではない。宿主が死んでしまえば、自分自身も子孫を残せないからである。ウイルスが野生動物から種の壁を超えてヒトや家畜に感染するようになる「spillover(流出)」によって新しい宿主に出会ったときに、重篤な病原性を発揮することが多いのである。
コウモリには大きな集団を作って密集して生活するものが多いので、ウイルスが宿主にするには格好の動物である。宿主が大きな集団を作っているということは、ウイルス集団も大きくなるということである。新しい宿主を開拓するためには、感染に際して使うたんぱく質を新しい宿主にあわせて改変する必要がある。そのような改変はランダムな変異とそれに対して働く自然選択によって可能になるが、ウイルス集団が大きいということは、それだけ新しい変異が生まれる可能性が高いということである。
ヒトや家畜も大きな集団を作って密集して生活するようになったので、ウイルスにとっては新たな宿主として格好の標的になる。ヒトは航空機を使って世界中を移動するので、COVID-19で体験したように感染は瞬く間に世界中に拡がることになる。
インフルエンザウイルスはもともとカモなどの水鳥を自然宿主としていると考えられる。インフルエンザウイルスは水鳥の腸管内で増殖し、糞便とともに水中に排泄される。ほかの水鳥がその水を飲むことによって伝搬されるのである。これらの水鳥は大きな集団を作って渡りをするものが多いので、ウイルスにとっては自身の分布を拡げるにも好都合である。
インフルエンザウイルスの場合も野生の水鳥に感染してもたいていは重篤な症状を引き起こすことはないが、新しい宿主として家畜のニワトリやブタ、それにヒトに感染すると高病原性になることが多いのだ。インフルエンザウイルスの進化については、この連載のあとのほうで再び触れることになるが、COVID-19が世界中のヒトに拡がった状況と似ている。
1. 山内一也(2020)『ウイルスの世紀 ― なぜ繰り返し出現するのか』みすず書房.
2. Li, K. et al. (2019) Emergence and adaptive evolution of Nipah virus. Transbound Emerg. Dis. 67, 121-132.
3. Leroy, E.M. et al. (2005) Fruit bats as reservoirs of Ebola virus. Nature 438, 575-576.
4. Gire, S.K. et al. (2014) Genomic surveillance elucidates Ebola virus origin and transmission during the 2014 outbreak. Science 345, 1369-1372.
5. Saéz, A.M. et al. (2015) Investigating the zoonotic origin of the West African Ebola epidemic. EMBO Mol. Med. 7, 17–23.
*もっと「進化」について知りたい人の入門書:
☆本連載が本になりました!
長谷川政美著『ウイルスとは何か:生物か無生物か、進化から捉える本当の姿』 (中公新書)。ウイルスは恐ろしい病原体か、あらゆる生命の源か――。進化生物学の最前線から、その正体に迫る。

☆いちばん新しい本!
長谷川政美著『進化生物学者、身近な生きものの起源をたどる
』 (ベレ出版)。 イヌやネコやクマなど身近な生き物はすべて進化していまここにいる。もちろんヒトも。生き物の進化が一目でわかる「系統樹マンダラ」を多数掲載(系統樹の「見方」付き)。ささやかな「現代版 種の起原」ができました。

☆はじめの一冊にオススメ!
長谷川政美監修・畠山泰英構成『世界でいちばん素敵な進化の教室
』 (三才ブックス)。 本書は美しい写真とQ&A形式の簡潔な文章で、38億年におよぶヒトを含む生き物の進化を解説した超入門ビュアルブックです。子供から大人まで気軽に楽しんでいただけます。
4刷(2022年10月)。





